Таблица
<<=
^
=>>
=>>
Ряд урана-актиния
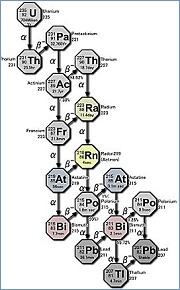
|
№89 Актиний 
История открытия:
В 1989 году, исследуя остатки урановой смолки, полученные после извлечения из нее радия и полония, сотрудник лаборатории супругов Кюри французский химик Андрэ Дебьерн установил наличие в ней еще одного радиоактивного элемента, который по аналогии с радием был назван производным от слова "луч", на этот раз взятого из греческого языка: aktiz - Актиний.
Год спустя, независимо от Дебьерна, это открытие повторил немецкий радиофизик Ф. Гизель, сумев выделить соединение актиния в относительно чистом виде.
Нахождение в природе и получение:
Содержание актиния в земной коре 6,5·10-15% по массе, т.е. примерно 2600 т. Радионуклиды Ac входят в состав природных радиоактивных рядов урана-235 (называемый также рядом актиния) и тория-232 и постоянно образуются на одной из стадий их распада, например: 235U(a)=> 231Th(b)=> 231Pa(a) =>227Ac. Период полураспада наиболее устойчивого изотопа, актиния-227 составляет 21,8 лет, кроме него в природе существует еще два относительно устойчивых изотопа: 225Ac (10 суток) и 228Ac (6 час.).
В основном, изотопы актиния получают искусственным путём, так изотоп 227Ac получают облучением радия нейтронами в реакторе: 226Ra(n,b-)227Ac. Выделение и очистка актиния от радия, тория и дочерних продуктов распада проводятся методами экстракции и ионного обмена. Металлический актиний получают восстановлением трифторида актиния парами лития при 1300-1350°C, в атмосфере аргона.
Физические свойства:
Актиний - серебристо-белый тяжелый металл, внешне похожий на лантан. Вследствие радиоактивности светится в темноте. Температура плавления - 1040°C, температура кипения - 3200°C(расчетн.), плотность - около 10 г/см3.
Ядра Ac-227 в основном испускают бетта-частицы, в процессе бетта-распада образуется изотоп тория: 227Ac = 227Th + 0b-. При альфа-распаде актиния образуется один из изотопов франция.
Химические свойства:
По химическим свойствам актиний сильно похож на лантан, в соединениях принимает степень окисления +3 (Ac2O3, Ac(OH)3, AcBr3), но отличается высокой реакционноспособностью и более основными свойствами.
Сильный восстановитель, реагирует с водой и разбавленными кислотами.
Важнейшие соединения:
Оксид актиния, Ac2O3 - белое крист. вещество, не растворимое в воде, может быть получен прокаливанием оксалата актиния.
Гидроксид актиния, Ac(OH)3 - белое желатинообразное вещество, мало растворимо в воде, растворяется, образуя соли в соляной, серной и азотной кислотах.
Соли актиния. Большинство солей актиния бесцветны. Хорошо растворимы в воде нитрат, хлорид, бромид и иодид актиния.
Исключением является AcF3, растворимость которого весьма мала. Малорастворимы также сульфат и оксалат актиния.
Применение:
Актиний-227 используется в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения актиния протекает ядерная реакция: 9Be + 4He = 12C + 1n. Ac-Be-источники характеризуются малым выходом гамма-квантов, применяются в активационном анализе при определении Mn, Si, Al в рудах.
Смесь изотопов 228Ac-228Ra используют в медицине как интенсивный источник гамма-излучения.
Актиний относится к числу опасных радиоактивных ядов, обладает способностью прочно удерживаться в организме в поверхностных слоях костной ткани. Опасность представляют и последующие радиоактивные продукты его распада.
Источники:
Актиний. Википедия, свободная энциклопедия. http://ru.wikipedia.org/Актиний.
Популярная библиотека химических элементов. Актиний. http://n-t.ru/ri/ps/pb089.htm.
|