Таблица
<<=
^
=>>
Ряд тория
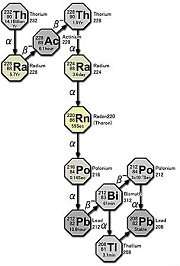
|
№90 Торий 
История открытия:
Торий был открыт Й. Берцелиусом в 1828 году, который выделил оксид неизвестного ранее элемента из минерала, позже получившего название торит (содержит силикат тория, ThSiO4). Элемент получил название по имени бога грома Тора в скандинавской мифологии. Чистый препарат тория был получен лишь в 1882 г. шведским химиком -Ларсом Фредериком Нильсоном.
Нахождение в природе и получение:
Торий почти всегда содержится в минералах редкоземельных элементов. Монацит, (Ce, Th)PO4, - важнейший источник и редкоземельных элементов, и тория. Он содержит, кроме церия другие редкоземельные элементы, а также уран. Содержание тория в земной коре - 8-13 г/т, в морской воде - 0,05 мкг/л. Входит в виде примесей, наряду с ураном, в состав породообразующих минералов гранита.
Соединения металлов, входящих в состав монацита, переводят в растворимое состояние. Далее, используя методы экстракции и ионного обмена торий выделяют из смеси соединений металлов в виде диоксида, тетрахлорида или тетрафторида.
Металлический торий получают из галогенидов или оксида методом металлотермии (кальций-, магний- или натрийтермии) при 900-1000°С, а также электролизом ThF4 или KThF5 в расплаве KF при 800°С на графитовом катоде. Полученный ториевый порошок спекают в вакууме при 1100-1350°C.
Физические свойства:
Торий - серебристо-белый блестящий, мягкий, ковкий металл. Температура плавления 1750°С; температура кипения 4788°С, плотность 11,8 г/см3.
Известны 30 изотопов тория но только один из них (торий-232) обладает достаточно большим периодом полураспада (14,05 миллиардов лет) по отношению к возрасту Земли, поэтому практически весь природный торий состоит только из этого нуклида. Некоторые из его изотопов могут определяться в природных образцах в следовых количествах, так как входят в радиоактивные ряды радия, актиния и тория.
Th-232 родоначальник большого ряда радиоактивных элементов, приводящего к устойчивому изотопу 208Pb.
Химические свойства:
На воздухе чистый металл медленно тускнеет и темнеет, при нагревании воспламеняется и горит ярко белым пламенем с образованием диоксида. Порошок тория пирофорен и его рекомендуют хранить в керосине.
При нагреве взаимодействует с водородом, галогенами, серой, азотом, кремнием, алюминием и рядом других элементов. Например, в атмосфере водорода при 400-600°С образует гидрид ThH2.
Относительно медленно корродирует в холодной воде, в горячей воде скорость коррозии тория и сплавов на его основе очень высока.
Торий растворим в концентрированных растворах НСl (6-12 моль/л) и HNO3 (8-16 моль/л) в присутствии иона фтора. Легко растворим в царской водке. Не реагирует с едкими щелочами.
Торий способен проявлять степени окисления +4 (наиболее устойчива), +3 и +2.
Важнейшие соединения:
Оксид тория, ThO2 - белое крист. вещество, тугоплавкое, не растворимое в воде, может быть получен прокаливанием нитрата, карбоната или оксалата тория. Реагирует с концентрированными серной и азотной кислотами, образуя соответствующие соли, с газообразным фтороводородом при высокой температуре, с оксидом кремния при сплавлении.
Гидроксид тория, Th(OH)4 - белое аморфное вещество, нерастворимо в воде, растворяется, образуя соли в соляной, серной и азотной кислотах. Реагирует с углекислым газом Th(OH)4+CO2 = Th(CO3)O +2H2O
Нитрат тория, Th(NO3)4 бесцветные кристаллы, растворимые в холодной воде, образует кристаллогидрат Th(NO3)4*5H2O. Горячей водой гидролизуется: Th(NO3)4 + 2H2O = Th(NO3)2(OH)2 + 2HNO3
Хлорид тория, ThCl4 бесцветные кристаллы, растворимые в холодной воде, образует кристаллогидраты, например ThCl4*8H2O. Сильный гидролиз по катиону.
Применение:
Торий имеет перспективы для развития атомной энергетики (уран-ториевый топливный цикл, реакторы на быстрых нейтронах, LFTR). В атомной энергетике применяются карбид, оксид и фторид тория (в высокотемпературных жидкосолевых реакторах) совместно с соединениями урана и плутония и вспомогательными добавками.
Торий в виде металла с успехом применяется в металлургии (легирование магния и др.), придавая сплаву повышенные эксплуатационные характеристики (сопротивление разрыву, жаропрочность).
Оксид тория из-за его наивысшей температуры плавления из всех оксидов (3350 K) идёт на производство наиболее ответственных конструкций и изделий, работающих в сверхмощных тепловых потоках, (облицовка камер сгорания и т.п.). Тигли, изготовленные из оксида тория, применяются при работах в области температур около 2500-3100 °C. Ранее оксид тория применялся для изготовления калильных сеток в газовых светильниках.
Добавка 0,8-1 % ThO2 к вольфраму стабилизирует структуру нитей ламп накаливания. Ксеноновые дуговые лампы почти всегда имеют торированные катод и анод, поэтому незначительно радиоактивны.
Торий и его соединения широко применяют в составе катализаторов в процессах органического синтеза и крекинга нефти, а также при получении жидкого топлива из угля.
Торий малотоксичен, постоянно присутствует в тканях растений и животных и человека (10-5 - 10-7%), и как природный радиоактивный элемент вносит свой вклад в естественный фон облучения организмов. При постоянном избыточном поступлении тория в организм способен накапливаться и вызывать онкологические заболевания. Граниты некоторых месторождений (ввиду слабой, но при длительном воздействии на человека опасной радиации) запрещено использовать в качестве наполнителя для бетона при строительстве.
Источники:
Торий. Википедия, свободная энциклопедия. http://ru.wikipedia.org/Торий.
Популярная библиотека химических элементов. Торий. http://n-t.ru/ri/ps/pb090.htm.
|