|
|
Решаем качественные задачи
Г.М. Можаев, Качественные химические задачи - это задачи, в которых количественные характеристики отсутствуют вообще, или они носят вспомогательный характер. Существуют различные типы качественных задач: Решение качественных задач предполагает использование определений, формулировок законов, написания и анализа химических формул и уравнений реакций, зарисовку приборов. Качественные задачи могут быть элементами комбинированных расчетных задач, а также составной частью задач, предлагаемых на экспериментальном туре олимпиады.
Из всего многообразия качественных задач остановимся, прежде всего, на первом типе.
Объяснение химических явлений требует, как правило, написания уравнений реакций. Задача осложняется тем, что вещества, участвующие в явлениях названы не все или вообще не названы. Таким образом, на первый план выходит определение неизвестных веществ и химических элементов по отдельным свойствам и признакам протекающих реакций.
Условия таких задач могут быть сформулированы в виде записи неполных схем реакций, например: Для решения такой задачи нужно внимательно проанализировать эти схемы, постараться найти что-то знакомое, догадаться. Конечно, такая догадка не возникает на пустом месте. Она придет тем легче, чем больше свойств веществ и признаков реакций вы знаете. Иногда схемы отдельных реакций соединяются в цепочку превращений, линейную или разветвленную, или в еще более сложную структуру:
Эта задача - пример того, что иногда подсказка может крыться не только в схемах, но и в тексте. Здесь эта подсказка заключена в слове "известняк". Знание важнейших минералов позволит вам понять, что схема относится к химии кальция, и постепенно расшифровать ее полностью.
И, наконец, такая задача может быть полностью представлена в текстовой форме:
Объемный текст с большим числом обозначений веществ, описаний свойств, множество другой разнородной информации способны привести решающего в состояние ступора. Первое, что можно посоветовать при решении такого вида задач - преобразовать их из текстовой формы в схематическую, вынести на эти схемы основную информацию текста. Это помогает лучше понять содержащуюся в тексте информацию, найти необходимые подсказки. Оказывается, всю задачу можно уложить в 4 строчки: Подсказками служит то, что C, D, Е - оксиды одного элемента X. Это приводит к мысли, что A - соединение элементов X и Y, а B - водородное соединение элемента Y. Одной из подсказок является и количественная характеристика - плотность по гелию. Молекулярная масса В (Mr=20) позволяет найти элемент Y = F (фтор). Схема постепенно конкретизируется:
Многочисленность оксидов, их окраски, агрегатное состояние, поведение одного из них на воздухе позволяют догадаться, что элемент X - это азот, а соединение А - фторид азота NF3.
Нередки подобные задачи и по органической химии, где подсказками могут служить брутто-формулы веществ, а целью - определение их строения:
Задача 4 (11 класс, обл.). Первый этап решения этой задачи аналогичен решению задачи предыдущей, только превращений здесь описано больше. Человеку, серьезно изучавшему органическую химию, многое скажут и используемые реагенты, и условия реакций, и молекулярные формулы веществ.
Простое сравнение молекулярных формул исходных веществ и продуктов способно подсказать сущность реакции. Так, "вычитая" из формулы вещества Б формулу вещества А, легко понять, что это превращение - реакция гидратации, сравнивая Б и Г, видим, что произошло отщепление одного атома углерода (в данных условиях в виде углекислого газа), а сравнение Г и Д наводит на мысль о реакции этерификации и образовании этилового эфира кислоты Г.
При определении возможного строения органических соединений полезным бывает определение его ненасыщенности: k = (2n+2-m)/2, где n - число атомов углерода, а m - число атомов водорода или других одновалентных заместителей (кислород не учитывается). Каждая единица ненасыщенности может реализоваться в структуре как цикл или π-связь. Для исследуемых веществ ненасыщенность равна: Большая степень ненасыщенности обычно свидетельствует о наличии в структуре ароматического кольца (1 цикл + 3 π-связи). Это позволяет предположить для вещества А строение фенилацетилена C6Н5-C≡CH, а для вещества Е - этилбензола: C6Н5-CH2-CH3 и постепенно разобраться в остальных веществах и реакциях.
В заключение нужно отметить, что качественные задачи этого типа встречаются не только в заданиях олимпиад, но и в заданиях государственной итоговой аттестации выпускников 9-х и 11-х классов. Так к задачам 1-го типа можно отнести задание С3 ГИА-9 по химии, задания С-3 и новый тип заданий С2 ЕГЭ по химии, например такое:
ЕГЭ-2012, С2 (составлено по аналогии с демо-версией). Напишите уравнения четырёх описанных реакций.
Отличие этого задания от олимпиадных задач, рассмотренных выше лишь в том, что нет буквенных обозначений веществ. Поэтому, возможно их придется вводить самостоятельно, составляя схемы реакций, описанных в задаче.
А вот один из примеров реальных заданий для выпускников 9-го класса:
ГИА-9-2011, С3 Таким образом, умение решать олимпиадные задачи поможет вам и на этапе государственной итоговое аттестации по химии. Желаю удачи!
|
|||||||||||||
. . |
||||||||||||||
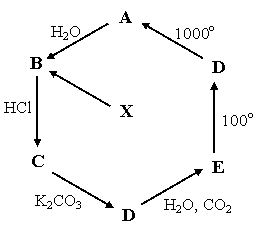 Задача 2 (9 класс).
Задача 2 (9 класс).