|
Назад
|
Всероссийская олимпиада школьников по химии 2005/2006 гОбластной этап. Экспериментальный тур. Получение и исследование свойств органической кислоты. Задание 1. В лаборатории обнаружена склянка, содержащая этиловый эфир, предположительно бензойной или салициловой кислоты. Вы должны получить кислоту и определить ее, сравнив ее свойства со свойствами выданных вам образцов кислот. Каким образом можно из сложного эфира получить кислоту? Что надо сделать, чтобы реакция прошла максимально быстро и с максимальным выходом? Как можно выделить кислоту из полученной реакционной смеси? Что такое салициловая кислота? Какими свойствами, в отличие от бензойной, она должна обладать? Какие качественные реакции можно провести для их распознавания? На выполнение этого задания Вам отводится 20-30 минут. Если вы справились раньше – сдайте отчет и получите у преподавателя задание 2.
"- - - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
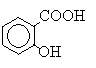
Салициловая кислота – это о-гидроксибензойная кислота: Гидролиз эфира. 1. В большую пробирку отмерьте 8 мл 16%-ного раствора NaOH, перенесите выданный вам образец эфира (2 мл, пл. = 1,05 г/мл), пробирку, в которой был эфир, ополосните этанолом (5 мл) и добавьте его в реакционную смесь. Пробирку с реакционной смесью поместите в кипящую водяную баню и нагревайте 20 – 30 минут. Каждые 5 минут вынимайте пробирку и осторожным встряхиванием перемешивайте содержимое. Что можно считать признаком полного протекания реакции? Какова роль спирта? За время протекания реакции исследуйте выданные вам образцы кислот (п. 4-8). 2. Охладите реакционную смесь до комнатной температуры, перелейте ее в чистый стаканчик и добавьте раствор серной кислоты до кислой реакции. Охладите стаканчик с выпавшими кристаллами в воде со снегом. 3. Отделите выпавшие кристаллы кислоты фильтрованием на стеклянном фильтре с отсасыванием (на дно фильтра положите маленький кружок фильтровальной бумаги). Промойте кристаллы на фильтре ледяной водой. Кристаллы перенесите на лист бумаги, высушите на воздухе и взвесьте. Исследование кислот 4. Растворимость. В пробирки с образцами кислот добавьте 5-6 мл дистиллированной воды. Происходит ли полное растворение? Отфильтруйте растворы кислот в чистые пробирки и сохраните для дальнейших реакций. 5. К оставшимся кристаллам добавьте по несколько капель раствора NaOH. Объясните наблюдаемое. 6. Отлейте пробу раствора каждой кислоты в чистую пробирку и добавьте 1-2 капли раствора хлорида железа(III). Запишите наблюдения, объясните различия. 7. К новым пробам растворов каждой кислоты добавляйте по каплям бромную воду. Запишите наблюдения, объясните различия. 8. Сделайте вывод, какая кислота находилась в каждой пробирке. 9. Немного кристаллов, полученных при гидролизе эфира, растворите в воде и проведите качественные реакции. Сделайте вывод о составе эфира 10. Уберите рабочее место и оформите отчет. В отчете приведите уравнения реакций, рассчитайте выход продукта.
"- - - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
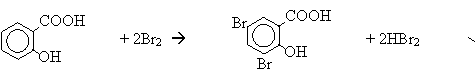
Решения экспериментального тура. Задание 1. План, методика, схемы реакций ясны из задания 2. Для увеличения скорости реакции гидролиз ведут при повышенной температуре, а чтобы сместить равновесие – в щелочной среде. При этом кислота переходит в водный раствор в виде соли. Этиловый спирт добавляют для увеличения растворимости эфира, что также способствует увеличению скорости реакции. Признаком окончания реакции можно считать исчезновение слоя эфира в пробирке, а также исчезновение характерного запаха эфира. Салициловая кислота содержит гидроксильную группу, связанную с ароматическим кольцом. Следовательно она должна, в отличие от бензойной кислоты обладать свойствами фенолов. В частности – это окрашивание с хлоридом железа(III) и реакция с бромной водой:
Обе кислоты плохо растворимы в воде, но легко растворяются в растворах щелочей, образуя соответствующие соли (бензоаты и салицилаты). Задание 2. Пример вычислений: Пусть в результате гидролиза образовалось 1,6 г кислоты (mпр). В реакцию вступило 2 мл эфира, n(эф) = m/M = 2*1,05/150=0,014 моль = n(к-ты)теор mтеор = nM = 0,014*122 = 1,71 г; выход =mпр/ mтеор = 1,6/1,71 = 0,93 = 93% Оценивание: Задание 1. Схема реакции, ответы на вопросы 5 баллов Задание 2. Отчет 5 баллов, расчеты 2 балла, техника работы 5 баллов, Дополнительные баллы участникам, первыми закончившим эксперимент, за быстроту и аккуратность в работе, при условии правильного выполнения и достаточно полного описания хода работы – до 3 баллов Суммарная оценка 20 баллов.
Можаев Г. М., старший преподаватель |
||
 Задание 2. (Выдается отдельно, после выполнения задания 1)
Задание 2. (Выдается отдельно, после выполнения задания 1)