|
9 класс
10 класс
11 класс
|
Девятый класс.
Задача 9-1.
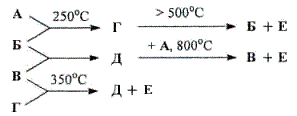
А, Б и В — простые вещества. А быстро реагирует с Б при нагревании до 250 °С, образуя темно-красные кристаллы соединения Г. Реакция Б с В после предварительной инициации протекает очень бурно, приводя к образованию бесцветного вещества Д, газообразного при нормальных условиях. Г, в свою очередь, способно реагировать с В при температуре 300-350°С, при этом красные кристаллы превращаются в белый порошок Е и образуется соединение Д. Вещество А вступает в реакцию с Д только при температуре около 800°С, при этом образуются Е и В. Вещество Г легко может быть сублимировано при пониженном давлении и температуре ниже 300°С, но при нагревании выше 500°С его пары разлагаются с образованием вещества Б и опять же соединения Е. Содержание одного и того же элемента в соединениях Д и Е составляет 97,26 и 55,94 масс.%, соответственно.
Вопросы.
1. Определите вещества А-Е.
2. Напишите уравнения всех упомянутых реакций в соответствии с приведенной схемой.
3. Как будут взаимодействовать вещества Г и Е с водными растворами сульфида и иодида натрия, с избытком концентрированного раствора цианида калия? Напишите уравнения реакций.
4. Напишите уравнения реакций, происходящих при взаимодействии веществ Г, Д и Е с концентрированной азотной кислотой.
(10 баллов)
Задача 9-2.
250-летию со дня рождения
Товия Егоровича Ловица
посвящается
В 1797 г. великий русский химик Товий Ловиц одним из первых установил многие химические свойства неизвестного раньше элемента - стронция и его важнейших соединений. В статье "Определение стронциановой земли в тяжелом шпате" учёный описал следующие факты:
"§ 8. Несколько капель купоросной кислоты дали с солекислыми растворами тяжелой и стронциановой земель помутнение и нерастворимые осадки...
Сахарная кислота дала помутнение с стронциановой землей несколько позднее, чем с известной землёй. Раствор тяжелой земли остался прозрачным.
Сахарнокислая растительная щелочная соль очень скоро замутила все три раствора...
Чистая фосфорная кислота не произвела ни в одном из растворов изменений. Напротив, при добавлении фосфорнокислой соды во всех трех растворах образовались осадки.
То же действие произвели буровая кислота и буровокислая растительная щелочная соль...
§ 15. Что касается количества находящейся в тяжелом шпате стронциановой земли, то из 100 частей сибирского тяжелого шпата я получил 2,8 части солекислой безводной стронциановой земли."
Вопросы.
1. Что такое: купоросная кислота, известная земля, тяжелая земля, стронциановая земля, сахарнокислая растительная щелочная соль, фосфорнокислая сода, буровая кислота, буровокислая растительная щелочная соль, солекислая безводная стронциановая земля? Приведите их химические формулы.
2. Почему щавелевую кислоту раньше называли сахарной?
3. Почему купоросная кислота дала с солекислыми растворами тяжелой и стронциановой земель нерастворимые осадки, а фосфорная кислота - нет?
4. Почему, в отличие от фосфорной кислоты, фосфорнокислая сода во всех трех растворах дала осадки?
5. Какая из упомянутых солей сахарной кислоты наименее растворима в воде?
6. Напишите в кратком ионном виде уравнения оговоренных в тексте реакций, обозначив щелочноземельный металл как М.
7. Рассчитайте, какова по данным Т. Ловица массовая доля стронция в тяжелом шпате.
(10 баллов)
Задача 9-3.
Каждый охотник желает знать,
где сидит фазан.
Соединение Ф (соединения такого типа называют «квасцами») представляет собой темно-фиолетовые октаэдрические кристаллы. При растворении Ф в воде получается фиолетовый раствор. При добавлении к этому раствору избытка раствора гидроксида калия образуется раствор зеленого цвета (вещество 3) (реакция 1). Если к полученному раствору добавить пероксид водорода, то раствор станет желтым (вещество Ж) (реакция 2). При подкислении раствора вещества Ж раствором серной кислоты раствор становится оранжевым (вещество О) (реакция 3). Прибавление к оранжевому раствору пероксида водорода и диэтилового эфира, приводит к образованию соединения С, которое окрашивает слой эфира в синий цвет (реакция 4).
Если же к подкисленному раствору вещества О добавить избыток цинка, то через некоторое время раствор приобретет интенсивную голубую окраску (вещество Г) (реакция 5).
К насыщенному раствору вещества О прилили концентрированной серной кислоты. При охлаждении полученного раствора выпали ярко-красные кристаллы вещества К (реакция 6).
Вопросы.
1. Приведите название и формулу квасцов (соединение Ф), если содержание воды в них 43,3%.
2. Приведите формулы соединений в соответствии с их цветом: красный, оранжевый, жёлтый, зеленый, голубой, синий, фиолетовый.
3. Напишите уравнения реакций образования веществ 1-6.
(10 баллов)
Задача 9-4.
Вещество А - один из немногих оксидов, традиционно относимых к несолеобразующим. Плотность А очень близка к плотности воздуха.
О веществе А известно следующее:
- оно реагирует с гидроксидом калия при давлении 5 атм. и температуре 120°С.
- оно чрезвычайно опасно для человека;
- оно вступает в реакции соединения с некоторыми металлами, например, железом, никелем и кобальтом.
- оно способно восстанавливать металлы из их оксидов.
Вопросы.
1. Установите вещество А. Приведите два примера несолеобразующих оксидов.
2. Напишите уравнение взаимодействия вещества А с гидроксидом калия.
3. Напишите уравнения взаимодействия вещества А с железом, никелем и кобальтом, если массовые доли металлов в образующихся соединениях составляют:
w(Fe) = 28,57%, w(Ni) = 34,50%, w(Co) = 34,20%?
4. Почему вещество А так опасно для организма человека?
5. Напишите уравнения восстановления двух металлов из их оксидов веществом А.
6. Вещество В имеет тот же качественный состав, что А и содержит 72,7 % кислорода. Зная, что энтальпия образования вещества В DН°обр(B) = -393,5 кДж/моль, а энтальпия реакции А + nO2 = В; DH°реакции = -283 кДж/(моль А), определите энтальпию образования вещества А (DH°обр(А)).
(10 баллов)
Задача 9-5.
В таблице приведенные данные по примерным температурам замерзания четырех растворов:
| № раствора | m(в-ва), г | V(H2O), мл | Tзам°C |
| 1 | 1,58 г хлорида натрия | 50 | -2 | |
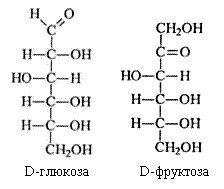
2 | 9,72 г глюкозы | 100 | -1 | | 3 | 3,02 г хлорида калия | 150 | -1 | | 4 | 38,9 г фруктозы | 200 | -2 |
 1. Вычислите моляльные концентрации этих растворов. (Моляльная концентрация показывает, сколько моль вещества растворено в 1 кг растворителя). Плотность воды принять равной 1 г/мл.
1. Вычислите моляльные концентрации этих растворов. (Моляльная концентрация показывает, сколько моль вещества растворено в 1 кг растворителя). Плотность воды принять равной 1 г/мл.
2. Привлекая данные п.1, объясните, почему изменение температур замерзания
(DТзам) растворов 2 и 4 по сравнению с температурой замерзания чистой воды отличаются в 2 раза.
3. Привлекая данные п.1, объясните, почему изменение температур замерзания
(DТзам) растворов 2 и 3 по сравнению с температурой замерзания чистой воды одинаковы.
4. Оцените, при какой примерно температуре начнет замерзать 3,0%-й раствор K2SO4.
(10 баллов)
|