|
Карта сайта
|
Окружная олимпиада школьников по химии 2007 г.Одиннадцатый класс.Задача 11-1.Твердый, кристаллический, легко возгоняющийся углеводород X состава C10H16 устойчив к действию бромной воды и раствора перманганата калия. При взаимодействии с парами брома на свету X образует смесь только двух моно-бромпроизводных А и В. Один из этих монобромидов (А) устойчив к действию как водных, так и спиртовых растворов щелочей. Второй бромид (В) реагирует с растворами щелочей, образуя только одно соединение С. Углеводород X может быть получен из легколетучего углеводорода D состава С6Н6, образующегося при крекинге или дегидрировании низкокипящих фракций многих российских нефтей. Основными компонентами этих нефтей, как установил еще В.В.Марковников, являются углеводороды, для которых он предложил название «нафтены». Углеводород D (т. кип. 38°С) при комнатной температуре медленно и обратимо превращается в высококипящую жидкость Е состава С10H12. Исчерпывающее гидрирование Е и последующее нагревание продукта гидрирования F с хлоридом алюминия (катализатор изомеризации) приводит к образованию X.
Задача 11-2.При обсуждении основности аминов используют константу основности Кb или, чаще, константу кислотности сопряженных им кислот, Кa(ВН+), описывающую равновесие ВН+ <=> В: + Н+. Так, в случае анилина равновесие C6H5NH3+ <=> C6H5NH2 + Н+ 1. Рассчитайте долю протонированного анилина при значениях рН: 1; 6; 10. Для ароматических диаминов первая константа протонирования обычно примерно равна соответствующей константе протонирования для анилина. Например, для 2. Предложите объяснение столь значительного различия в основности этих соединений. Обычно циклические амины проявляют более высокую основность, чем их ациклические аналоги. Например, значения рКa(ВН+) для триэтиламина и хинуклидина 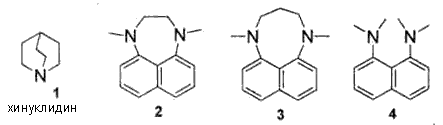 3. Почему хинуклидин 1 проявляет более высокую основность, чем триэтиламин? Объясните, почему основность соединения 2 намного ниже, чем основность соединения 4. Нитрование 4 азотной кислотой в уксусной кислоте дает единственное соединение 5, содержащее 32,5% кислорода, как при использовании одного эквивалента, так и при действии избытка азотной кислоты. При нитровании одним эквивалентом азотной кислоты в серной кислоте с выходом до 70% образуется продукт 6, содержание азота в котором равно 16,2%. 4. Напишите структурные формулы 5 и 6 и объясните различия в нитровании при проведении реакции в уксусной и в серной кислотах. Взаимодействие 4 с избытком ацетилхлорида в присутствии хлорида алюминия приводит к образованию продукта 7 состава C18H20N2O. 5. Напишите структурную формулу соединения 7 и предложите механизм его образования. Задача 11-3.Для металла М известны следующие превращения: 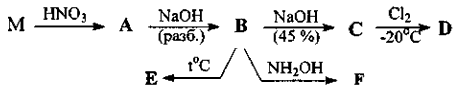 При получении А образуется раствор синего цвета, при образовании С - раствор густо-синего цвета, причем в обоих случаях в растворах находятся только вещества А и С, соответственно. Соединение В - светло-голубой осадок, соединение Е черного цвета, F - твердое вещество грязно-оранжевого цвета, которое при обработке концентрированной соляной кислотой образует бесцветный раствор, а при хранении на воздухе постепенно превращается в Е. Соединение D разлагается уже при слабом нагревании, а соединение Е устойчиво по крайней мере до 800°С. Содержание М в Е составляет 79,9%.
Задача 11-4.Простейший ненасыщенный углеводород этилен, получаемый из нефтяных газов, является одним из главных сырьевых источников тяжелого (крупнотоннажного) органического синтеза. Химические свойства этилена чрезвычайно разнообразны и приводят к целому ряду интересных продуктов. Ниже приведена схема превращений этилена, которые протекают с участием гомоядерных незаряженных частиц Чi (i = 1-5). Эти частицы содержат только атомы элемента А и используются в химических превращениях как в форме индивидуальных веществ (Ч3 - Ч5), так и в виде короткоживущих интермедиатов (Ч1, Ч2). 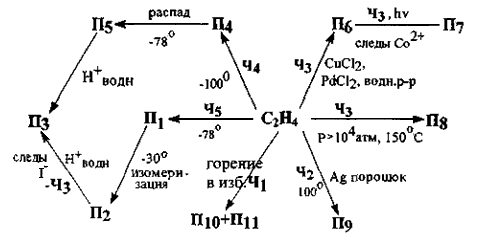
Задача 11-5.Молекулярное соединение С с интересной структурой может быть получено из хлорида металла М по схеме: 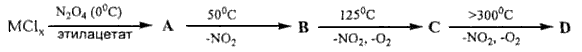 Если массу А принять за 100%, то общая потеря массы при образовании В составляет 58,0%, при образовании С - 66,7%, при образовании D - 92,1%.
|
||||
|
Источник: Архангельская О.В., Жиров А.И., Лебедева О.К., Решетова М.Д., Теренин М.И., Трушков И.В., Тюльков И.А. Методические материалы для проведения |
|||||