Всероссийская олимпиада школьников по
химии
2005/2006 г.
Федеральный окружной этап.
Деcятый класс.
Задача 10-1.
Ниже приведены уравнения термолиза солей А - F
1) A → X + Y + Z + W;
2) B → 2X + Y + Z + W;
3) С → 2Х + Y + Z;
4) D → Х + Y + W;
5) Е → X + Y + Z;
6) F → 2X + Z.
О реакции 1) известно следующее:
а) A разлагается без твердого остатка;
b) все продукты реакции - бинарные соединения;
c) в продуктах реакции два соединения содержат водород, а два других - углерод:
d) три продукта являются оксидами;
e) суммарное содержание кислорода, углерода и водорода составляет 86,916 %;
f) MZ > MW > MY > MX.
Определите все вещества и назовите их. Примечание: атомные веса считать целочисленными.
(10 баллов)
Задача 10-2.
«Для количественного определения газа X используют следующие реакции:
1. Пропускание над пятиокисью иода при 130-140 °С.
2. Пропускание через аммиачный раствор хлористой меди. Для приготовления раствора берут 200 г хлористой меди, 250 г NH4Cl, 750 мл Н2O и взбалтывают в бутыли (раствор А). На 3 объема этого раствора надо прибавить 1 объем аммиака плотностью 0,91 г/мл (С = 227 г/л). Сохраняют над металлической медью. Проба 1 мл такого раствора (раствор Б) обратимо поглощает 16 мл X.»
(Спутник химика. ОНТИ, Госхимиздат, т.3. 1934).
3. Пропускание через водный раствор хлорида палладия (II) приводит к образованию черного осадка.
Для качественного обнаружения в помещении газа X в прошлом использовали канареек.
Сэр Г. Дэви исследовал реакцию газа X с хлором и впервые получил вещество Y, которое можно рассматривать как хлорангидрид минеральной кислоты.
1. Определите газ X. Напишите уравнения реакций газа X с пятиокисью иода, аммиачным раствором хлористой меди и водным раствором хлорида палладия.
2. Для чего при приготовлении раствора хлористой меди добавляют NH4Cl и почему раствор хранят над металлической медью? Назовите соединение, получающееся при взаимодействии газа X с аммиачным раствором хлористой меди.
3. Какие еще количественные способы удаления X Вы знаете? Напишите уравнения реакций.
4. Определите формулу вещества Y, назовите его и напишите уравнение реакции с водой.
5. Рассчитайте молярные концентрации всех ионов, находящихся в растворе Б, если плотность раствора А равна 1,21 г/мл, пренебрегая изменением объема при сливании растворов.
(10 баллов)
Задача 10-3.
Через 100 г водного раствора, содержащего 1,55% перманганата калия и 0.294% серной кислоты при 17° и давлении 740 мм. рт. ст. пропустили цис-бутен-2 до полного исчезновения окраски. Выпавший осадок отделили центрифугированием и получили 100 мл бесцветного раствора, содержащего только одно органическое соединение, способное вызывать растворение гидроксида меди (II).
1. Напишите уравнения проходящих реакций.
2. Изобразите структурную формулу продукта. Обладает ли это соединение оптической активностью?
3. Вычислите объем углеводорода (н.у.), вступившего в реакцию.
4. Вычислите рН получившегося раствора.
(автор Ю.Н. Медведев, 10 баллов)
Задача 10-4.
Промышленно важный углеводород A (tкип = 34 °С) получают в технике различными способами. По одному из них, изопентан подвергают дегидрированию, а образующуюся смесь углеводородов обрабатывают сернистым газом. При этом только один из углеводородов обратимо образует соединение X, которое содержит 24,2% серы. При термическом разложении соединения X получается углеводород А.
По другому способу, газообразный изобутилен пропускают через 35-40 % раствор формалина, содержащего 1-2% серной кислоты. При этом образуется соединение состава C6H12O2, которое при пропускании перегретого водяного пара разлагается с образованием углеводорода А.
Если углеводород А выдерживать в запаянной ампуле в инертной атмосфере при 80-90 °С, то из продуктов реакции можно выделить жидкость В (tкип = 172-189 °С). в состав которой входит по меньшей мере три углеводорода (Bl, B2 и В3) с преимущественным содержанием углеводорода В1. Гидрирование жидкости В при 20 °С дает единственный углеводород С. Пропускание паров смеси В над палладиевым катализатором приводит к образованию смеси углеводородов С и D, при этом масса смеси не изменяется.
Углеводороды С и D можно получить встречным синтезом: при взаимодействии толуола с пропиленом в присутствии фосфорной кислоты получается углеводород D. гидрирование которого при повышенной температуре и давлении в присутствии платинового катализатора приводит к образованию углеводорода С.
1. Напишите структурные формулы упомянутых веществ и уравнения соответствующих реакций.
2. Рассчитайте мольные доли компонентов С и D в смеси, полученной при нагревании жидкости В.
3. Объясните образование углеводородов В2 и В3 в ходе превращения углеводорода А.
4. Назовите оптически активные углеводороды, упомянутые в задаче.
(10 баллов)
Задача 10-5.
Ниже представлены рисунки элементарных ячеек (ЭЯ) трех типов кристаллических структур и их названия.
1. Кубическая гранецентрированная.
2. Кубическая простейшая.
3. Кубическая объемноцентрированная.
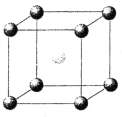 A A |
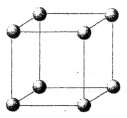 B B |
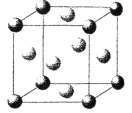 C C |
I. Установите соответствие между названием и рисунком. Ответ дайте в виде «буква-цифра».
II. Известно, что кристаллическая решетка меди — кубическая гранецентрированная. Атомный радиус меди 128 пм.
1. Вычислите длину ребра элементарной ячейки кристалла меди (L).
2. Вычислите объем элементарной ячейки меди.
3. Вычислите, сколько атомов меди содержится в элементарной ячейке.
4. Вычислите плотность кристаллической меди (г/см3).
5. Выведите формулы для нахождения длины ребра ЭЯ (L) через атомный радиус (R) для простейшей кубической и объемноцентрированной кубической решеток.
6. Предполагая, что медь может кристаллизоваться в объемноцентрированной кубической ЭЯ, вычислите ее плотность в этом случае.
(автор Ю.Н. Медведев, 10 баллов)
Задача 10-6.
«... кислота [А], весьма распространена въ растительномъ царствЪ и обыкновенно получается изъ лимоннаго сока предварительнымъ осажденiемъ въ видЪ известковой соли [Б] и разложенiемъ послЪдней сЪрной кислотой. Строенiе ... кислоты [А] установлено ея синтезомъ изъ симметрическаго дихлорацетона [В], который присоединенiемъ синильной кислоты [реакция 1] и разложенiемъ кипящей соляной кислотой [реакция 2] переводится въ дихлордиметоксаловую кислоту [Г]. Натрiевая соль дихлордиметоксаловой кислоты при нагрЪвании съ цiанистымъ калiемъ [реакция 3] и послЪдовательнымъ разложенiемъ соляной кислотой [реакция 4] даетъ ... кислоту [А]. Трехосновность .:. кислоты [А] доказывается ея солями. Четырехатомность ... кислоты [А] доказывается существованiемъ тетрэтильнаго эфира [Д], получаемаго изъ средняго эфира [Е] дЪйствiемъ натрiя [реакция 5] и iодистаго этила [реакция 6]... При осторожномъ продолжительномъ нагрЪванiи ... кислоты [А] при 140° [реакция 7], получается аконитовая кислота [Ж], которая плавится при 187°. распадаясь [реакция 8] на угольный ангидрид и ... кислоту [З]».
(Н. Меншуткин. "Лекцiи органической химiи".
С.-Петербургь, 1897. с. 651—652).
1. Приведите структурные формулы "симметрическаго дихлорацетона" [В], дихлордиметоксаловой кислоты [Г] и кислоты [А]. Напишите уравнения реакций 1-4
2. Дайте название "известковой соли" [Б] и кислоте [А].
3. Известно, что эфир [Е] образуется при исчерпывающей этерификации кислоты [А] этанолом. Приведите структурную формулу «средняго эфира» [Е]. Напишите уравнения реакций 5 и б и структурную формулу «тетрэтильнаго эфира» [Д].
4. Какова структурная формула аконитовой кислоты [Ж] (С6Н606)? Напишите уравнение реакции 7.
5. Изобразите все возможные структурные формулы кислоты [3], если известно, что при протекании реакции 8 выделяется эквимолярное количество угольного ангидрида.
Уравнения реакций 1-7 должны содержать все продукты и стехиометрические коэффициенты.
(10 баллов)
По материалам пособия:
О.В. Архангельская, А.И. Жиров, О.К. Лебедева и др. Методические материалы
для проведения четвертого (федерального окружного) этапа
Всероссийской
олимпиады школьников по химии (задания теоретического тура).
ЦМК Всероссийской химической олимпиады школьников, 2006.