Областная олимпиада школьников по
химии
|
||||||||||||||||||||||||||||||||||
| Решения, 9 класс |
Девятый класс.Задача 9-1.«Реактивная бумага для открытия небольших количеств свободных галоидов (безцветная йодная бумага). Приготовление. Нагревают до полного растворения и обезцвечивания 1 гр. иода, 7 гр. кристаллической соды, 3 гр. крахмальной муки и 1 л. воды; полученный раствор разводят до 1 л. и им пропитывают белую бумагу. Последняя, от малейших следов свободных галоидов, окрашивается в ………… цвет». (А.И. Коренблит «Химические реактивы, их приготовление, свойства, испытания и употребление», М, 1902, стр.183). 1. Напишите уравнение реакции, которая протекает при приготовлении реактива. 2. Определите молярные концентрации веществ в полученном растворе (крахмал можно не учитывать). 3. Какую среду имеет раствор, используемый для получения реактива? Напишите ионное и молекулярное уравнение реакции, определяющей среду раствора. 4. На примере газообразного галогена напишите уравнение реакции, иллюстрирующей действие индикатора, укажите в какой цвет он окрашивается. 5. Какие газообразные вещества (кроме галогенов) могут дать аналогичную окраску с индикаторной бумажкой? (Приведите пример уравнения реакции). (автор А.И.Жиров, 10 баллов) Задача 9-2.Водород является экологически чистым топливом (почему?). Какие способы получения водорода вы можете предложить (уравнения реакций)? Рассчитайте, какое расстояние сможет пройти машина на баллоне с водородом объемом 50л, при давлении в баллоне 150 атм (считать 1 атм = 100000 Па), температуре 27°С, если на 100 км тратится 7 л бензина. Известно, что плотность бензина 830 кг/м3, а теплота, выделяющаяся при сгорании бензина, составляет в среднем 42 МДж/кг.
КПД для водородного и бензинового двигателя считать одинаковым. Термохимическое уравнение реакции горения водорода (по задаче Ю.Н.Медведева, 7 баллов) Задача 9-3.При взаимодействии неизвестного металла массой 0,225 г с избытком азотной кислоты выделилось 89,6 мл (н.у.) смеси оксидов азота(II) и азота(IV) с плотностью по водороду 17. Определите металл. ( 7 баллов) Задача 9-4.«Лунный элемент» Э был открыт в 1817 г шведским химиком Берцелиусом, он же и предложил его название. Э является сильным ядом, действующим при поступлении в организм подобно мышьяку. Э своих минералов практически не образует, в природе сопутствует сере. В чистом виде Э твердое вещество, обладающее серым цветом с металлическим отсветом…. Э энергично взаимодействует с фтором, при нагревании с хлором, кислородом. При взаимодействии Э с кислородом можно получить только один оксид, белый, твердый при комнатной температуре ЭО2. Кислота, образованная Э, водородом и кислородом (w(Э)=0,545), способна растворять золото. (С.С.Бердоносов, А.И.Жиров «Справочник школьников по неорганической химии» М. 1997) 1. Назовите элемент Э. Ответ обоснуйте. 2. Напишите реакции Э с фтором, хлором, кислородом. 3. Установите формулу кислоты и напишите уравнение реакции этой кислоты с золотом. 4. Э образует с серой соединение под названием сульсен, которое используют в медицине. Какова может быть формула этого соединения? (автор Дима Игнатьев, 9 баллов) Задача 9-5.Соли многих известных Вам неорганических кислот используются в быту и промышенности. Ниже предложен перечень кислот, солей, катионов и применение солей. Ваша задача выписать к каждому из названий кислоты (столбец I) название соли этой кислоты (столбец II) и ее применение (столбец III). Каждая строка любого столбца может быть использована Вами не более одного раза. В дополнительном столбце IV приведите формулы солей.
(автор С.А.Серяков, 5 баллов) |
|||||||||||||||||||||||||||||||||
| Решения, 10 класс |
Десятый класс.Задача 10-1.«Лунный элемент» Э был открыт в 1817 г шведским химиком Берцелиусом, он же и предложил его название. Э является сильным ядом, действующим при поступлении в организм подобно мышьяку. Э своих минералов практически не образует, в природе сопутствует сере. В чистом виде Э твердое вещество, обладающее серым цветом с металлическим отсветом…. Э энергично взаимодействует с фтором, при нагревании с хлором, кислородом. При взаимодействии Э с кислородом можно получить только один оксид, белый, твердый при комнатной температуре ЭО2. Кислота, образованная Э, водородом и кислородом (w(Э)=0,545), способна растворять золото. (С.С.Бердоносов, А.И.Жиров «Справочник школьников по неорганической химии» М. 1997) 1. Назовите элемент Э. Ответ обоснуйте. 2. Напишите реакции Э с фтором, хлором, кислородом. 3. Установите формулу кислоты и напишите уравнение реакции этой кислоты с золотом. 4. Э образует с серой соединение под названием сульсен, которое используют в медицине. Какова может быть формула этого соединения? (автор Дима Игнатьев, 8 баллов) Задача 10-2.Одно из чудес, доступных настоящему мастеру - это изменение внешнего вида металлов. На сайте www.alhimik.ru приводится такой рецепт для "окраски" медных изделий: «растворяют в 100 мл воды 12,5 г карбоната аммония и добавляют 4 мл нашатырного спирта. Полученный раствор кистью наносят на поверхность изделия и получают поверхность зеленоватого цвета». 1. Рассчитайте примерные молярные концентрации веществ в полученном растворе, считая, что объем раствора остался равным примерно 100 мл, а нашатырный спирт представляет собой 10%-ный раствор, с плотностью около 1г/мл; 2. Предложите формулу вещества образующего зеленое покрытие и уравнения реакций, протекающих при окраске металла. 3. Почему раствор наносится кистью? Что изменится, если опустить медь в закрытый сосуд со смесью карбоната аммония и нашатырного спирта? 4. Можно ли вместо карбоната аммония использовать карбонат калия? Ответ аргументируйте. (по задаче Ф.Н.Новикова, О.В.Матусевича, 10 баллов) Задача 10-3.«Приготовление... Горькая или английская соль получается растворением магнезита в серной кислоте (1). (Цитировано по «Химические реактивы, их приготовление, 1. Установите состав английской соли, если известно, что при 132° теряется 44% по массе, а масса твердого остатка после прокаливания при 240° составляет 48,8% от исходной массы соли. 2. Напишите уравнения реакций 1 и 2. 3. Укажите число паев N и вещество А, теряющееся при нагревании. 4. При нагревании осадка X выделяется бесцветный газ с характерным запахом. Каков состав осадков X и Y? Напишите уравнения реакций их образования. (автор O.K.Лебедева, 10 баллов) Задача 10-4.Приведена схема превращений металла X. Определите этот элемент, продукты A-E, и напишите уравнения всех химических реакций. 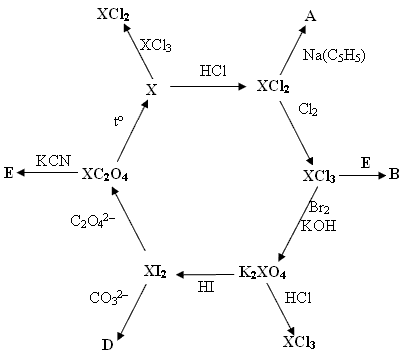
(автор А.В.Задесенец, 10 баллов) Задача 10-5.Для устойчивого горения пиротехнической смеси без доступа воздуха необходимо, чтобы на 1 г этой смеси исходных веществ выделялось не менее 1,5 кДж теплоты. Вычислите массы угля (допустимо считать его чистым углеродом) и хлората калия, которые нужно взять для получения 100 г такой смеси. Энтальпия сгорания угля -394 кДж/моль, энтальпия разложения хлората калия -48 кДж/моль. Хватит ли выделяющегося кислорода для сгорания рассчитанной порции угля? (автор Загорский В.В., 6 баллов) |
|||||||||||||||||||||||||||||||||
| Решения, 11 класс |
Одиннадцатый класс.Задача 11-1.Четыре навески металла М массой по 0,144 г растворили в избытке кислоты X. Выделившиеся газовые смеси, состав и объем которых зависел от концентрации кислоты, содержали только газы А, В, С и D. При добавлении к полученным растворам избытка щелочи газ дополнительно не выделялся.
Определите газы А, В, С, D, металл М и кислоту X. (автор В.Е.Шаронов) Задача 11-2.Соединение А (формула C7H6O2) плохо растворяется в воде, но хорошо растворяется в водном растворе гидроксида натрия с образованием соли Б (формула C7H5O2Na). В результате взаимодействия соли Б с бромной водой образуется соединение В, в котором массовая доля брома составляет 54,054%. Восстановлением 12,2 г соединения А водородом на платиновом катализаторе при 20°С получено 10,8 г соединения Г. 1.Установите формулы соединений А, Б, В и Г. 2. Для монохлорпроизводного соединения А можно предложить только две изомерных формулы. Определите строение веществ А и В. 3.Напишите уравнения реакций. 4.Определите выход в реакции получения вещества Г. (автор В.И.Тереннн, 10 баллов) Задача 11-3. Температурный коэффициент Вант-Гоффа для реакции: 1. Как изменяется скорость (константа скорости) химической реакции при увеличении температуры? Какова причина такого изменения скорости? 2. Приведите математические уравнения, показывающие зависимость скорости (константы скорости) химической реакции от температуры исходя из уравнения Вант-Гоффа и из уравнения Аррениуса. Какое из этих уравнении универсальней, т.е. работает в большем интервале температур и скоростей? 3. Во сколько раз изменится константа скорости реакции при возрастании температуры с 25°С до 60°С? 4. Рассчитайте энергию активации приведенной реакции. (автор О.В.Архангельская, 10 баллов) Задача 11-4.Для ненасыщенных углеводородов характерно существование нескольких видов изомерии. 1. Напишите все структурные формулы ациклических изомерных углеводородов с шестью углеродными атомами, из которых: один атом углерода в sp3-гибридизации, один атом углерода в sp-гибридизации, 4 атома углерода в sр2-гибридизации. Назовите все соединения по систематической номенклатуре. 2. Назовите виды изомерии, которые существуют в этих углеводородах. 3. Напишите полное молекулярное уравнение реакции одного из изомеров, которое будет протекать при кипячении с раствором перманганата калия, подкисленным серной кислотой. (авторы С.С.Чуранов и М.Д.Решетова, 11 баллов) Задача 11-5.Углеводород A (C5H8) может быть получен следующим образом: 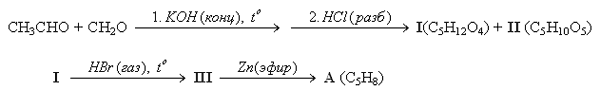 1. Приведите структурные формулы всех углеводородов состава C5H8, не содержащих кратных связей. 2. Изобразите структурные формулы веществ I, II, III и А, если известно, что для А возможно существование только одного монохлорпронзводного. 3. Определите вещества и напишите уравнения описанных реакций. (автор А. А. Зайцев, 10 баллов) |
|||||||||||||||||||||||||||||||||
|
При подготовке заданий использовались материалы пособия: |
||||||||||||||||||||||||||||||||||