|
Олимпиада
|
Зональная олимпиада школьников по
химии 2006/2007 г.
Девятый класс.
Задача 9-1.
Веселый
молочник оставил в холодке кувшин с двумя литрами молока (жирность 4%,
плотность 1,025 г/мл). Спустя некоторое время веселый кот Борис слизал с
поверхности молока 150 г отстоявшихся сливок с жирностью 15%. Сколько энергии
получил кот Борис, если считать, что при окислении в организме 1 г жира выделяется 39,8 кДж?
Сколько еще сливок достанется коту, если оставшееся «снятое» молоко имеет
жирность 2%? Учитывая, что состав жира можно выразить формулой
C43H80O6, найдите тепловой эффект реакции окисления жира до
оксида углерода(IV) и воды и напишите термохимическое уравнение.
(7 баллов)
Задача
9-2.
В 1797
году английский химик Теннант, исследуя природу одного драгоценного камня, сжег
образец его массой 0,033 г в плотно закрытом золотом тигле с отводной трубкой.
При этом оказалось, что объем выделившегося углекислого газа соответствует
объему газа, получаемому при сжигании такой же порции древесного угля. О каком
камне идет речь? Какой объем газа (н.у.) должен был получить Теннант? Будет ли
количество выделившейся при этом теплоты больше или меньше количества теплоты,
полученной при сжигании угля? Почему?
(5 баллов)
Задача
9-3.
Предельно
допустимая концентрация оксида углерода(II) в воздухе
составляет 3 мг/м3.
Каково содержание оксида углерода(II) в воздухе, если при
пропускании 20 м3 воздуха через трубку, в ней выделилось 0,1 г иода? Сколько молекул CO
содержится при этом в одном кубометре воздуха? Допустимо ли пребывание людей в
такой атмосфере?
(6 баллов)
Задача
9-4.
В каждую из 4-х колб добавили по 50 мл 0,1М раствора HCl, затем по 0,1 г одного из перечисленных веществ: NaOH, KOH, NaHCO3, AgNO3. В одной из колб выпал осадок, и его отфильтровали. К сожалению, на следующий день незадачливый химик не смог вспомнить, в какой колбе проводилась какая реакция. Подскажите, как это можно определить, используя индикатор и раствор NaOH с концентрацией 0,1 моль/л. Ответ подтвердите ионными уравнениями реакций и расчетами.
(8 баллов)
Задача 9-5.
В состав сухой смеси входят следующие вещества: CuSO4, ZnSO4, SrSO4 и NH4Cl. Предложите наиболее удобный способ разделения смеси и получения указанных солей в чистом виде. Напишите соответствующие уравнения реакций.
(9 баллов)
Решения
Зональная олимпиада школьников по химии 2006/2007 г.
Десятый класс.
Задача 10-1.
Для обработки ран и ссадин используется «зелёнка» - 1%-ный раствор органического красителя бриллиантового зеленого. Известно, что это вещество содержит в своем составе углерод, водород, азот, серу и кислород, причем мольное отношение N:S:O = 2:1:4, общая массовая доля этих элементов в веществе 25,62%, и при сжигании 0,01 моль красителя образуется 3,24 г воды и 6,048 л оксида углерода(IV). Определите формулу бриллиантового зеленого и число его молекул в одной капле зелёнки (объем капли 0,02 мл, плотность раствора равна плотности воды).
(7 баллов)
Задача 10-2.
Порошок магния массой 3 г поместили в фарфоровую лодочку и некоторое время нагревали в токе воздуха. Затем содержимое лодочки извлекли и разделили на две равные части. К первому образцу добавили концентрированный раствор КОН - при этом растворения вещества не произошло, но выделился газ объемом 134,4 мл (н.у.). Оказалось, что этот газ хорошо растворим в воде, причем в полученном растворе фенолфталеин становится малиновым. Второй образец полностью растворился в избытке раствора HCl, при этом наблюдалось вскипание, и выделился в 5 раз больший объем нерастворимого в воде газа. Объясните эти наблюдения, определите состав порошка, полученного в ходе реакции (массовые доли).
(9 баллов)
Задача 10-3.
Смесь пропена с водородом с плотностью по водороду 15 нагревали в закрытом сосуде с платиновым катализатором, пока давление в сосуде не уменьшилось на 20% по сравнению с первоначальным. Рассчитайте состав исходной и полученной смеси в процентах по объему, а также выход продукта реакции от теоретически возможного.
(7 баллов)
Задача 10-4.
Напишите уравнения 6 реакций соответствующих следующей схеме превращений:

Для окислительно-восстановительных реакций напишите уравнения электронного баланса, укажите окислитель и восстановитель. (8 баллов)
Задача 10-5.
В шести неподписанных пробирках находятся следующие кристаллические вещества
Ba(NO3)2, Na2SO4, Pb(NO3)2, CaCO3, MgCl2, Na2CO3.
Составьте план определения веществ без использования других реактивов, кроме воды. Приведите молекулярные и ионные уравнения реакций.
(7 баллов)
Решения
Зональная олимпиада школьников по химии 2006/2007 г.
Одиннадцатый класс.
Задача 11-1.
Смесь 36 г уксусной кислоты, 7,36 г безводного этанола и некоторого количества серной кислоты нагревали в течении некоторого времени. После охлаждения смесь разделили на две равные части. К одной из них добавили избыток раствора хлорида бария, при этом выпало 2,33 г осадка. Ко второй половине добавили избыток питьевой соды, при этом выделилось 6,05 л газа. Рассчитайте состав исходной и полученной смеси (массы веществ), а также выход продукта реакции от теоретически возможного. (8 баллов)
Задача 11-2.
Для химии серы характерно образование большого числа кислородсодержащих кислот с общей формулой HXSYOZ. Большинство из них неустойчивы, но их соли выделены в чистом виде. При реакции 0,01 моль натриевой соли одной из этих кислот израсходовано 200 мл 0,2М раствора KMnO4 в присутствии HNO3 и был получен бесцветный раствор, в котором содержалось 4,8 г сульфат-ионов. При этом содержание ионов натрия в растворе соответствовало 1,42 г Na2SO4. Установите формулу соли и соответствующей кислоты. Какова степень окисления серы в ней? Предложите структурную формулу кислоты. Напишите уравнение реакции соли с перманганатом калия, используя метод электронного баланса или полуреакций.
(9 баллов)
Задача 11-3.
Напишите уравнения реакций, соответствующие следующей схеме, укажите условия их проведения:
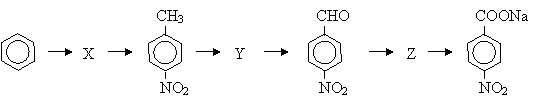
(6 баллов)
Задача 11-4.
К водороду объемом 28,85 л (измерен при 20oС и нормальном давлении) добавили 177,8 г иода и выдержали до установления равновесия при температуре 800oС, при этом выделилось 8,4 кДж теплоты. Рассчитайте константу равновесия реакции
H2 + I2 ↔ 2HI, если теплота образования HI равна 7 кДж/моль.
(8 баллов)
Задача 11-5.
При утилизации отходов электронной промышленности получен лом металлов, содержащий железо, алюминий, медь и серебро. Опишите способ количественного определения содержания каждого металла в этой смеси, приведите уравнения химических реакций.
(6 баллов)
Решения
|