|
|
Зональная олимпиада школьников по химии 2006/2007 г. Решения задач, десятый класс.
Примечания автора сайта Задача 9-1. Определим массу жира в съеденных котом сливках: m(жк) = m(с)*w = 150*0,15 = 22,5 г; и количество энергии полученной им: Е = 22,5*39,8 = 895,5 кДж; (1 балл) Определим исходную массу молока и содержание жира в нем: m(м) = V*r = 2000*1,025 = 2050 г; m(ж) = m(м)*w = 2050*0,04 = 82 г; (1 балл) Пусть при отстаивании образуется х г сливок с жирностью 15%. Тогда останется 2050 - х г снятого молока. Выразим массу жира в снятом молоке и в сливках: m(жсн) = m(сн)*wсн = (2050 - х)*0,02 = 41-0,02x; m(жc) = m(с)*wс = 0,15x (1 балл) Составим уравнение: 41-0,02x + 0,15x = 82. (1 балл) Отсюда х = 315 г , В кувшине остается еще 315 - 150 = 165 г сливок. (1 балл) Рассчитаем количество энергии для одного моля жира: Уравнение реакции: C43H80O6 +60O2 = 43CO2 +40H2O +27542 кДж (2 балла) (7 баллов) Не все участники внимательно прочитали условие, кое-кто пытался получить сливки из уже снятого молока. В результате, коту Борису мало что доставалось, а то и вообще ничего. Вторая проблема - расчет теплового эффекта реакции. Успешность 18%, максимальный балл, полученный участником, - 7. Задача 9-2. 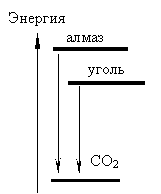
Поскольку при сгорании одинаковых образцов образуется одинаковый объем углекислого газа, постольку драгоценный камень, как и древесный уголь состоит из углерода. Таким камнем может быть только алмаз (1 балл) С + O2 = CO2↑ + Q; Найдем количество вещества углерода: n(С)=m(С)/M = 0,033 / 12 = 0,00275 моль = 2,75 ммоль. По уравнению реакции n(CO2) = n(C) = 2,75 ммоль. и его объем V(CO2) = n*VM = 2,75 *22,4 = 62 мл. (1 балл) Древесный уголь состоит из кристалликов графита, более устойчивой аллотропной модификации, чем алмаз. Более устойчивой, значит обладающей меньшей энергией, чем алмаз. Как видно из энергетической диаграммы, при сгорании алмаза выделяется несколько больше теплоты, чем при сгорании такого же количества угля. (3 балла) (5 баллов) Большинство участников правильно определили, о каком драгоценном камне идет речь, хотя кто-то решил, что им может быть ... каменный уголь или фантастическое вещество с формулой Au2CO2. Основной проблемой стал третий вопрос. Нелогичными были утверждения: "у алмаза кристаллическая решетка прочнее, поэтому при сгорании выделится больше теплоты". Ведь если решетка прочнее, то на ее разрушение надо затратить больше энергии. Более логично считать, что "у алмаза кристаллическая решетка прочнее, поэтому при сгорании выделится меньше теплоты", но этот ответ неверен. Действительно ли кристаллическая решетка алмаза прочнее? Как же быть с известным фактом, что алмаз твердый, а графит мягкий? Дело в том, что в кристаллической решетке графита есть разные связи - очень непрочные между слоями и прочные, "полуторные", в слоях. При измерении твердости разрушается не вся кристаллическая решетка, а только связи между слоями - естественно, графит оказывается мягким. Но вот при горении приходится разрывать все связи, и, оказывается, суммарная энергия связей в графите выше, чем в алмазе. Так же и при возгонке. Успешность 16%, максимальный балл 3. Задача 9-3. Уравнение реакции: I2O5 + 5CO = I2 + 5CO2; (2 балла) Определим количество вещества иода: n = m/M: n(I2) = 0,1/254 = 0,000394 = 3,94*10-4 моль ; (1 балл) По уравнению реакции количество вещества СО в 5 раз больше и равно 19,7*10-4 моль, Таким образом, содержание СО в воздухе составляет 55,2/20 = 2,76 мг/м3, что меньше ПДК и допускает пребывание людей. (1 балл) В одном кубометре воздуха n(CO) = 19,7*10-4/20 = 9,84*10-5 моль, (6 баллов) Основная проблема задачи - умение аккуратно работать с очень большими и очень маленькими числами. Успешность 27%, максимальный балл 6. Задача 9-4. Уравнения реакций: 1) HCl + NaOH = NaCl + H2O; OH- + H+ = H2O 2) HCl + KOH = KCl + H2O; OH- + H+ = H2O 3) HCl + Na2HCO3 = NaCl + H2O + CO2; HCO3- + H+ = H2O + CO2; 4) HCl + AgNO3 = AgCl + HNO3; Cl- + Ag+ = AgCl (2 балла) Хотя массы добавленных веществ одинаковы, но количества вещества разное. Поэтому в полученных растворах останется разное количество избыточной соляной кислоты. В последнем случае (с AgNO3) концентрация ионов водорода и общая концентрация кислоты останется неизменной. Для определения нужно добавить в каждую колбу индикатор и постепенно добавлять раствор гидроксида натрия (титровать) до изменения окраски, измеряя затраченный объем раствора. (2 балла) Проведем расчеты: (см. таблицу) (4 балла) Количество вещества HCl (исходное) n(HCl) = c*V = 0,1моль/л*50 мл = 5 ммоль
* + 0,59 ммоль HNO3 (8 баллов) Основная ошибка - считать, что если к кислоте добавлена щелочь, то среда будет нейтральная! Нет, все зависит от того, сколько было кислоты и сколько добавили щелочи. Не все поняли, что сокращение 0,1М надо читать как 0,1 моль/л. Успешность 20%, максимальный балл 7. Задача 9-5. Обработаем смесь водой, при этом растворятся все соли, за исключением нерастворимого SrSO 4. После фильтрования добавим к полученному раствору избыток концентрированного раствора щелочи. При этом протекают реакции: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4; ZnSO4, + 2NaOH = Zn(OH)2↓ + Na2SO4; Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] NH4Cl + NaOH = NaCl + NH3↑ + H2O; (3 балла) Выделяющийся аммиак улавливаем раствором соляной кислоты и вновь получаем хлорид аммония: HCl + NH3 = NH4Cl. (1 балл) Осадок гидроксида меди отфильтруем и растворим в серной кислоте, получим раствор сульфата меди: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O. (0,5 балла) В фильтрате содержится терагидроксоцинкат и сульфат натрия, а также избыток щелочи. Для разделения удобнее всего пропускать через раствор ток углекислого газа до полного осаждения гидроксида цинка: Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3 (1 балл) Гидроксид цинка отфильтруем и также растворим в серной кислоте: Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O. (0,5 балла) Выпариванием полученных растворов выделим исходные соли в чистом виде. План разделения - 3 балла, уравнения реакций - 6 баллов (9 баллов) Многие участники путают понятия "разделить" и "различить" и предлагают качественные реакции. Как правило, для разделения нужно перевести вещества в разные фазы, подобрать такие реактивы, чтобы что-то растворить, а что-то нет, что-то осадить, а что-то оставить в растворе. При этом желательно использовать наиболее доступные реактивы. Вторая проблема - не просто написать набор уравнений реакций, а предложить последовательный план действий. Задача оказалась самой сложной: Успешность 6%, максимальный балл 4. |
||||||||||||||||||||||||||||||
|
Можаев Г. М., старший преподаватель |