Таблица
<<=
^
=>>
Раствор соли берклия(III), полученной при подготовке синтеза элемента № 117
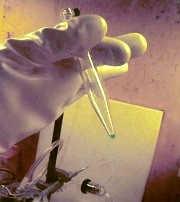
|
№97 Берклий 
История открытия:
Берклий был синтезирован в 1949 году на циклотроне Радиационной лаборатории Калифорнийского университета группой ученых (Стэнли Томпсон и Альберт Гиорсо и Л. Морган) по руководством Гленна Сиборга. Название берклий получил в честь города, Беркли, где находилась эта лаборатория и где были получены первые атомы этого элемента.
Нахождение в природе и получение:
Берклий практически отсутствует в природной среде, за исключением районов, которые использовались для испытаний ядерного оружия, а также на участках ядерных инцидентов, таких как катастрофа на Чернобыльской АЭС , авария на АЭС Три Майл Айленд и на авиабазе Туле B-52.
Его первый синтез был осуществлен при при бомбардировке мишени из америция-241 ускоренными на 60-дюймовом циклотроне α-частицами: 24195Am + 42He → 24397Bk + 210n.
Различные изотопы берклия могут быть получены при облучении нейтронами изотопов урана, плутония, учитывая это, берклий постепенно накапливается при работе специализированных ядерных реакторов. Но выход его мал. Так, когда в 2009 году для получения элемента №117 Теннессина потребовалась мишень из берклия, ее готовили в течение 250-дневного периода облучения, продукт еще очищали в течение 90 дней, получив в итоге 22 миллиграмм берклия-249. Берклий-249 образуется также в качестве побочного продукта при производстве калифорния-252, но и там выход его очень мал.
Большую сложность представляет выделение соединений берклия из образующейся при этом смеси изотопов различных элементов. Разделение может быть достигнуто методом ионнообменной хроматографии.
Металлический берклий был получен восстановлением фторида берклия(III) парами лития при 1000°С:
BkF3 +3Li = Bk +3LiF. Он также может быть получен путем восстановления оксида берклия(IV) торием или лантаном.
Физические свойства:
Берклий - это мягкий, серебристо-белый, радиоактивный металл. Температура плавления - 986°C, температура кипения - 2627°С.
Всего известно около 20 изотопов берклия, с массами от 235 до 254. Наиболее долгоживущие из них 247Bk (Т1/2 = 1380 лет) и 249Bk (β-излучатель с периодом полураспада Т1/2 = 314 дней);
Реакция бетта-распада берклия-249 приводит к калифорнию: 24997Bk = 24998Cf + β-. Второй важный изотоп, берклий-247, является альфа-излучателем, как и большинство изотопов актинидов: 24797Bk = 24395Am + 42He.
Химические свойства:
Берклий с сухим воздухом реагирует медлено, покрывается оксидной плёнкой, при нагревании быстро окисляется до BkO2. Реагирует также с водородом , галогенами , халькогенами и пниктогенами с образованием различных бинарных соединений.
Растворяется в соляной и азотной кислотах, с образованием солей берклия(III)
В соединениях способен проявлять степени окисления +3 (наиболее устойчива), +2(предполагается) и +4.
Важнейшие соединения:
Соединения берклия(II) - известны галогениды BkCl2, BkBr2 и BkI2, черного цвета. Они очень чувствительны к кислороду и окисляются в воде, выделяя водород и переходя в соединения Bk (III).
Соединения берклия(III) - Оксид берклия(III), Bk2O3 - желто-зеленое твердое вещество, растворимое в соляной и азотной кислотах. Его получают восстановлением BkO2 водородом.
Оксиду соответствует нерастворимый в воде гидроксид Bk(OH)3,
- Соли берклия(III): растворимые нитрат, хлорид, образуют кристаллогидраты (например, BkCl3*6H2O) и растворы зеленого цвета. Нерастворимы фторид, оксалат, йодат, фосфат.
Соединения берклия(IV) Оксид берклия(IV), BkO2 - коричневое твердое вещество,
образуется при окислении берклия кислородом, или при разложении на воздухе кислородсодержащих солей берклия(III), растворим в соляной и азотной кислотах, при растворении обычно восстанавливается с образованием солей Bk(III).
Галогениды берклия(IV) известны лишь в твердой фазе: BkF4 представляет собой желто-зеленый ионный твердый продукт, Cs2BkCl6 - твердое вещество оранжевого цвета.
Применение:
Наиболее доступный изотоп берклия, 249Bk используется для радиохимических исследований и получения более отдалённых трансуранов, вплоть до фермия.
Более широкое применение берклия затруднено сложностью его получения и высокой ценой.
Берклий - радиотоксичный элемент, опасный не столько собственным излучением, сколько излучением продуктов своего распада.
Источники:
Берклий. Википедия, свободная энциклопедия. http://ru.wikipedia.org/Берклий.
Популярная библиотека химических элементов. Берклий. http://n-t.ru/ri/ps/pb097.htm.
.
|