|
-
|
Федеральный стандарт и преподавание курса химии в основной школе
Конспект выступления О.С. Габриеляна на семинаре
Преподавание курса химии в основной школе должно строится на основе федерального стандарта и входящего в его состав базового минимума. Это приводит к новым сокращениям содержания. Ничего хорошего в этом нет, но это действительно разгружает курс основной школы, котрорый сохранял весь материал еще от программы 3+2 часа. Основные сокращения:
Как быть с ЕГЭ? Те, кто пойдут на наш профиль, будут изучать эти вопросы в старшей школе. Те, кто не пойдут - не выберут химию на ЕГЭ. Как быть с аттестацией школы, учителя по контрольным работам от проверяющих? Результаты любой аттестации можно опротестовать, если задания срезовых работ не соответствуют федеральному стандарту. Как быть с олимпиадами? Учитель не обязан на уроках готовить к олимпиадам. Подготовка к олимпиадам этто индивидуальная штучная работа, которая должна проводиться в отдельное время и это время должно быть учителю оплачено. Нельзя пенять учителю на отсутствие такой подготовки, если эта нагрузка не оплачивается. В разработанный нами учебно методический комплект для 8 класса входит переработанный учебник "Химия-8", рабочая тетрадь, тетрадь для лабораторных и практических работ, сборник контрольных и проверочных работ. Изменение содержания привело к коррекции тематического планирования курса химии 8 класса. Содержательная часть учебника при этом изменилась мало. Существенно обновлен иллюстративный материал - пополнен большим числом цветных фотографий.
Введение.
Следующие несколько тем составляют раздел "Химическая статика" Тема 1. Атомы химических элементов.
Тема 2. Простые вещества.
Тема 3. Сложные вещества.
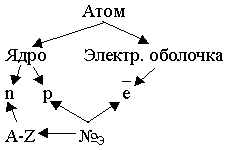
Например, урок "Основания". Вызываем ученика к доске, просим составить формулу из атомов натрия, водорода и кислорода. Каковы связи в этом веществе? И ионная, и ковалентная. А какие ионы? Оказываются, ионы могут быть не только простые, но и сложные. Проработка различия понятий заряд и степень окисления. Это нужно разделить. Обозначение зарядов ионов (у ионов только + или 2+, степень окисления +1, +2) Номенклатура: Устанавливаем генетические связи: поставь стрелочку напиши формулу оксида, которому соответствует этот гидроксид. Классификация: растворимые и нерастворимые. Расчеты: по массе найти количество вещества, число ионов каждого вида. Вводим новые понятия: "качественные реакции", "индикаторы". Эти идеи продолжаем развивать при изучении следующего класса веществ "Кислоты". Соли рассматриваются как производные кислот. Заполняется вместе с учениками табличка:
Одновременно ученики знакомятся со шпаргалкой №3 - таблицей растворимости. Второй урок посвящаем отработке генетической связи. Вместе с учениками создаем схему: Идет отработка таких схем. и работа по повторению с помощью этих схем (Кальций, азот - тип связей, оксиды, основания, кислоты, и так до нитрита кальция. Из каких ионов состоит? Сколько ионов? каковы заряды? Из скольких атомов? Степень окисления?) Этой темой заканчивается изучение раздела "Химия в статике" Прошло 33 урока, первое полугодие учебного года. Со следующей темы начинается изучение изменений веществ, "Химии в динамике" Тема 4. Изменения, происходящие с веществами.
Тема 5. Практикум №1.В программе 5 работ, но две из них можно передать на домашний эксперимент: "Наблюдения за горящей свечой" и "Анализ почвы и воды". Освободившиеся часы можно использовать для отработки навыков по предыдущей теме. Тема 6. "Теория электролитической диссоциации".Это - важнейшая тема 8 класса, ради нее строился весь курс химии 8 класса. Чего нет у меня: молекулярных представлений о реакциях в растворе. Сразу раскрывается истинный механизм реакции в растворах: это ионное взаимодействие.
1 урок. Сформулируем четыре основных положения ТЭД: Уроки 2-5. Кислоты. Проблемный эксперимент: два неподписанных пузырька, в одном соляная, в другом серная кислота. Добавим кусочки цинка. Протекает одинаковая реакция, выделяется газ, водород. (Лучше с помощью кодоскопа)
Следующий опыт - три пробирки с CuO, три кислоты, везде наблюдаем образование голубого раствора, записываем:
Три урока распределяются по плану: Что хотите делайте но добейтесь, чтобы свойства кислот были выучены пусть на это уйдет четыре урока, дальше будет проще работать. 6-7 уроки - Основания. По той же схеме. 9-10 уроки - Оксиды 11-13 уроки. Соли. 14 урок. Окислительно-восстановительные реакции. Уметь распознать, без требования расстановки коэффициентов(?). 15-16 уроки. Подготовка к контрольной работе. 17 урок. Контрольная работа №3. 18-19. Практические работы. |
|||||||||||||||||||||||||||
|
- |
Планирование и некоторые вопросы методики курса химии 9 класса.Один из сложных вопросов методики 9-го класса - как читать органику. Я разложу все по полочкам. Введение (6 часов)1 урок. Металлы. 2 урок Неметаллы. Вы должны сказать при самоанализе этих уроков: "Уроки были построены на развитии мышления". Основные этапы уроков:
Далее рассматривается изменение по периодам и группам свойств соединений: оксидов, гидроксидов, водородных соединений, генетический ряд элемента. Урок 3. Амфотерность. (ознакомительно). Урок 4. Периодическая система и периодический закон в свете строения атома. Урок 5. Подготовка к контрольной работе. Урок 6. Констатирующая КР №1. Тема 1. Металлы. (9 часов)Металлы даются в общем плане, без дробления на группы. Это обусловлено сложностью девятого класса: класс в определенном смысле выпускной, предпрофильный, ученикам не хватает ориентиров, они не хотят учить и т.п.
Урок 1. Положение в Периодической системе, строение атома и кристаллические решетки, общие физические свойства металлов. Сплавы. Метод: беседа, демонстрация коллекций. Новым для школьников является понятие сплавы. Рассматриваем как твердые растворы, металлическая связь и металлическая КР. Классификация сплавов: Урок 2-3. Общие химические свойства металлов. Урок 4. Металлы в природе, общие способы получения металлов. Урок 5. Коррозия и способы защиты от нее. Как уже говорилось, этот вопрос не входит в федеральный стандарт, но я считаю необходимым его рассмотреть. Рассматриваем как ОВР: Мео - ne = Men+. На простейшем примере (литий). Отмечаем, что коррозия не только зло но и благо: процессы в гальванических элементах по сути своей тоже коррозия. Приводим интересные факты (одна из причин гибели "Титаника", как полагают, химические ошибки при проектировании и строительстве, заклепки корпуса были изготовлены из другого металла, что способствовало коррозии). Урок 6. Жесткость воды. Тема также введена вопреки стандарту, в связи ее большой значимостью. Методы смягчения воды (кипячение, "калгон" - фосфаты калия(?)). Урок 7. Практическая работа. Урок 8. Подготовка к контрольной работе. Урок 9. КР №2. Тема 2. Неметаллы.Урок 1. Положение в Периодической системе, строение атомов и кристаллические решетки, аллотропия, физические свойства неметаллов. (кислород, фосфор, углерод). Урок 2. Общие химические свойства неметаллов. Отмечаем, что дляних характерны как окислительные (реакции с металлами, водородом) так и восстановительные (реакции со фтором, кислородом, сложными веществами окислителями). Есть и свой ряд активности (для галогенов). Урок 3. Неметаллы в природе, общие способы получения неметаллов. Что такое литосфера? Оксиды кремния и металлов. Гидросфера - вода. Получение - реакции восстановления и окисления (разложение воды, например). Урок 4. Водород. Урок 5. Галогены. Урок 6. Кислород. Урок 7. Сера. Урок 8. Сероводород, сульфиды. Урок 9. Оксиды серы. Урок 10. Серная кислота и ее соли. Урок 11. Серная кислота как окислитель, получение применение серной кислоты. Урок 12. Азот. Урок 13. Аммиак. Урок 14. Соли аммония. Урок 15. Оксиды азота. Урок 16. Азотная кислота как электролит, получение. Урок 17. Азотная кислота как окислитель, применение. Урок 18. Нитраты и нитриты. Урок 19. Фосфор. Урок 20. Кислородные соединения фосфора. Урок 21. Углерод - еще раз останавливаемся на аллотропии. Кокс, сажа, тушь, древесный уголь, активированный уголь, адсорбция, противогазы. Урок 22. Оксиды углерода. Урок 23. Угольная кислота, ее соли. Урок 24. Кремний. Урок 25. Кислородные соединения кремния. Урок 26. Силикатная промышленность. Урок 28-30. Практические работы. Среди них работа по получению, собиранию, распознаванию газов. Урок 32. Подготовка к контрольной работе. Урок 33. КР №3. Тема 3. Органические соединения (8 уроков - 8 пишем, 7 в уме)
Урок 1. Предмет органической химии, понятие о валентности и химическом строении.
Отмечаем несовпадение понятий степень окисления и валентность, как Урок 2. Углеводороды. Метод: беседа, работа учащихся Насыщенные: метан, этан - ученики записывают развернутые структурные формулы. Что будет, если от молекулы этана оторвать два атома водорода? "От голода" образуется еще одна связь между углеродными атомами - приходим к понятию ненасыщенные углеводороды: этилен, ацетилен. Качественные реакции без записи уравнений реакций. "Голодные" молекулы способны присоединяться друг к другу - реакция полимеризации, полиэтилен - пример применения углеводородов. Горение углеводородов и их применение как источника энергии. Урок 3. Спирты. Мостик с предыдущего урока гидратация этилена: СН2=СН2 + НОН « СН3-СН2ОН; затем формулы: С2Н5ОН; R-ОН
Даем общее представление о многоатомных спиртах, рассматривая в качестве представителя широко применяемый глицерин. Качественная реакция с гидроксидом меди. Урок 4. Карбоновые кислоты. Даем представление о функциональной группе и общей формуле карбоновых кислот R-COOH, в качестве представителя рассматриваем уксусную кислоту. Напоминаем общие свойства кислот и вводим новое свойство: реакция этерификации и знакомим с классом сложных эфиров. На словах объясняем образование жиров при взаимодействии жирных кислот с глицерином:
Урок 5. Аминокислоты и белки. Приводим формулы простейших аминокислот и рассматриваем их взаимодействие между собой. Отмечаем, что при этом выделяется вода ("конденсируется") вводим термин реакция поликонденсации. Отмечаем роль этой реакции в синтезе природных веществ - белков. Записываем словами и отмечаем обратимость процесса:
Отмечаем биологические функции белков: строительные, ферментативные и др., в том числе имунная функция (антитела, антитоксины). Урок 6. Углеводы. От названия к формуле Cn(H2O)m, и С6Н12О6. Основные свойства глюкозы - реакция с гидроксидом меди без нагревания и с нагреванием.
Урок 7. Практическая работа №5. Идентификация органических соединений. Качественные реакции. Используем также для подготовки к контрольной работею Урок 8. КР №4 Готовлю конвертики, откуда ученики вытаскивают карточки с названиями или формулами веществ. Задания: Итого в представленных темах 6+9+33+8=56 часов. Оставшиеся 12 часов можно рассматривать как резервные, можно использовать для рассмотрения тем одной из тем-модулей, включенных в программу: "Химические вещества в сельском хозяйстве" или "Химия и экология" (для городских школ). Конспект подготовлен автором сайта. |
|||||||||||