|
На главную страницу
|
. |
Комбинированная задача в заданиях ЕГЭ по химииРасчеты: объемных отношений газов при химических реакциях; массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества, одно из веществ находится в избытке. В этих заданиях от школьников требуется не просто использовать имеющиеся у них знания, но синтезировать на основе их новые. Так в школьном курсе химии достаточно много говорится о восстановительных свойствах водорода и аммиака, но лишь по отношению к оксидам металлов. Говорится и об окислительных свойствах кислородных соединений азота, но, главным образом, при рассмотрении азотной кислоты. Участникам экзамена года надо самим додумать, что при взаимодействии водорода (или аммиака) с оксидами азота пойдет окислительно-восстановительная реакция с образованием наиболее устойчивых веществ, азота и воды. К сожалению, это оказывается по силам немногим. Задача 1 (2004 г., успешность 2,8%).Оксид азота(II) объемом 1,57 л (н.у.) смешали с аммиаком, полученным при действии избытка едкого натра на 2,64 г сульфата аммония. Полученную газовую смесь нагрели при 300оС до завершения реакции. Установите объемные отношения газов в полученной смеси после охлаждения ее до 0оС.
Возможное решение и критерии оценивания:
При выполнении задания С-4 оказывается, что значительная часть школьников путают нитриды, нитриты и нитраты, фосфиды и фосфаты и т.п. Одной из сложных задач была задача на взаимодействие хлора с раствором щелочи с образованием хлората (причем большая часть решавших похоже просто не знала, что такое хлорат). К недостаткам выполнения расчетной части решения задач следует отнести неумение некоторых школьников использовать для расчетов молярные отношения, правильно определять вещество, полностью вступившее в химическую реакцию. Много ошибок допускается и при определении состава раствора, полученного в ходе химической реакции, при поглощении газов, растворении веществ, выпадении осадков. Задача 2. (2005 г., 17%). Хлор, выделившийся при взаимодействии 43,5 г оксида марганца(IV) с 36%-ным раствором HCl объемом 500 мл и плотностью 1,18 г/мл, пропустили через горячий раствор гидроксида калия массой 600 г, с массовой долей 28%. Определите массовую долю хлората калия в полученном растворе.
Решение и критерии оценивания:
В примечаниях к критериям расчетных задач отмечается, что любая последовательность решения, приведшая к правильному ответу, оценивается максимальным баллом. Оценка снижается, когда: допущены ошибки в уравнении химической реакции или формуле (на 1 балл); имеются погрешности в расчетах (на 1 балл). При неверном ответе оцениваются лишь правильно выполненные элементы решения.
*) Для лучшего понимания задачи ее можно «нарисовать». Вот так это будет выглядеть на схеме превращения фаз (Твердая фаза показывается прямоугольником, жидкая - овальной фигурой, газ - треугольником. Сложная по составу фаза показывается разделением фигуры на несколько частей, с разной штриховкой для разных веществ). Для решения данной задачи наиболее важна схема второго процесса, позволяющая определить массу полученного раствора: 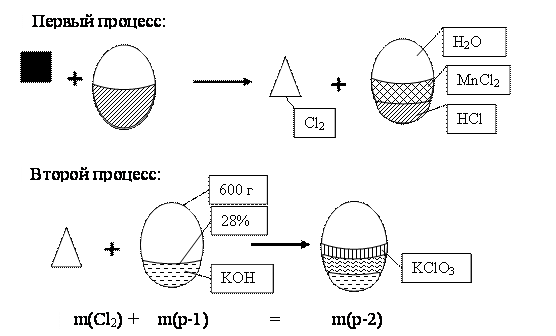
|
||||||||||||||||||||||||
|
Г.М. Можаев
|
||||||||||||||||||||||||||