Карта сайта
Условия
| Поделиться в |
Олимпиада школьников основной школы по химии, 2012-2013 уч.г.
Восьмой класс.
(решения)
Задача 1. Кроссворд "Ёлка юного химика".
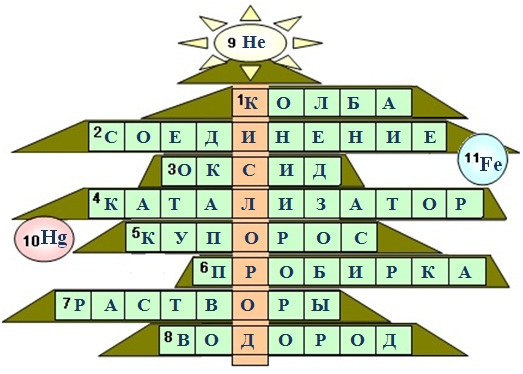
1.↓ Самый нужный химический элемент
1.→ Сосуд для химических реакций
2. Вещество, состоящее из двух или более элементов
3. Он образуется при горении
4. Нужен для ускорения химических реакций
5. Красивые синие кристаллы - медный …
6. В ней тоже проводят химические реакции, когда вещества немного
7. Смеси соли с водой,
сахара с водой это …
8. Самый легкий, но если смешать с п.1, то получится гремучий
Украшения (вписать символы элементов ):
9. Этот элемент назвали в честь бога Солнца. Бог солнца у древних греков - Гелиос. Элемент, который сначала, по своим спектральным линиям, был обнаружен на солнце и лишь затем был найден на земле, назвали гелий.
10. Латинское название этого элемента - гидраргирум. Гидраргирум от латинского: "жидкое серебро" - это латинское название ртути.
11. Элемент, благодаря которому кровь переносит кислород. Переносчиком кислорода является железосодержащий белок гемоглобин, содержащийся в красных кровяных тельцах - эритроцитах. Перенос кислорода обусловлен спосбностью иона железа(II) образовывать координационную связь с молекулой кислорода.
Задача 2. Число электронов в атоме равно порядковому номеру, таким образом N1+N2 = 29. Значит это элементы третьего периода, магний (N=12) и хлор (N=17). Соединение этих элементов MgCl2 - хлорид магния. Отсутствие формулы или названия считалось ошибкой.
Задача 3. Гидроксид металла со степенью окисления (валентностью) +2 должен иметь формулу M(OH)2, т.е. содержать 2 атома кислорода. Массовая доля кислорода в этом гидроксиде определяется по формуле
w(O)=2Ar(O)/Mr.
Это позволяет рассчитать относительную молекулярную массу гидроксида
Mr = 2Ar(O)/w(O) = 2*16/0,187 = 171.
Отсюда Ar(M) = 171-34 = 137. Металл Ва - барий.
Задача 4. Молярную массу вещества можно рассчитать по формуле:
M = m/n, где n - количество вещества (моль)
а) Если известно число молекул, то количество вещества можно найти используя число Авогадро
(NA = 6,02*1023 моль-1).
В данном случае n = N/NA = 4,21*1022/6,02*1023 = 0,07 моль.
Тогда M = 3,08/0,07 = 44 г/моль.
б) Доступный газ с такой молярной массой, который могли получать школьники - углекислый газ, CO2.
Могли быть предложены и другие газы, например, N2O - оксид азота(I) или C3H8 - пропан.
в)Пересчитать молекулы газа невозможно. Но если найти объем колбы, в которую собран газ а значит и объем газа, то количество вещества можно определить по формуле n=V/VM, используя VM=22,4 л/моль (если условия не слишком отличаются от нормальных). Для нахождения объема колбы ее можно заполнить водой и затем использовать мерный цилиндр.
Задача 5. Все, что есть в торте, и тесто, и крем, и шоколад, и сладкая водичка - все состоит из атомов разных химических элементов (углерода, водорода и кислорода, в основном). Поэтому, если из этого торта вытащить (мысленно, конечно) все-все атомы, то от торта ничего не останется. Впрочем, от него и так осталось немного ... ;)
Можаев Г. М., старший преподаватель
Тюменского государственного университета