Карта сайта
Олимпиада
Теория:
|
9 |
10 |
11 |
Областная олимпиада школьников по химии 2009/2010 г.
Одиннадцатый класс.
Задача 11-1.
Некоторое белое кристаллическое вещество А при нагревании на воздухе испытывает ряд превращений, последовательно образуя белые кристаллические вещества Б-Г. Навеску 5 г вещества А последовательно нагревали до температур, соответствующих полному превращению в соединения Б, В и Г, после чего определяли массу образца.
Результаты экспериментов суммированы в таблице.
| Температура, K | Вещество | Масса образца, г | Реакция |
| 273 | А | 5,0000 | - |
| 423 | Б | 4,3475 | 1 |
| 573 | В | 4,0213 | 2 |
| 723 | Г | 2,5717 | 3 |
В другом эксперименте образцы А-Г массой по 5 г каждый растворяли в 95 г воды и определяли рН полученных растворов. Оказалось, что растворы А-В имеют рН около 2,5, тогда как раствор Г нейтрален.
Вопросы.
1. Определите вещества А-Г и напишите уравнения реакций, последовательно происходящих при нагревании вещества А.
2. Объясните, почему величина рН водного раствора Г существенно отличается от величин рН растворов А-В.
3. Что будет происходить с соединением Г при дальнейшем нагревании?
4. Каково геометрическое строение структурных единиц, из которых построены в-ва А и В?
5. Где может использоваться соединение А?
(автор Р.В. Панин)
Задача 11-2.
И, изменив свою окраску,
Пустились в пляску, колдовские.
Леонид Мартынов
На схеме представлены превращения соединений, содержащих переходный металл Х.
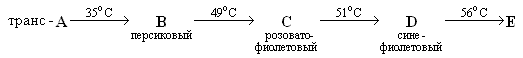
Известно, что: 1) А (w(X)=24,77% ) кристаллизуется из водного раствора Е и содержит 15,13% кристаллизационной воды;
2) при добавлении к раствору, содержащему 8,29 г А, избытка раствора AgNO3 выпадает 10 г белого осадка;
3) вещество С содержит 35,51% Х по массе.
4) переходный металл Х присутствует в малых концентрациях в минералах никелин и купферникель.
Вопросы.
1. Определите Х и соединения А-Е. Ответ подтвердите расчётом.
2. Объясните геометрическое строение веществ А и С.
3. Предположите цвета соединений А и E.
4. Напишите ещё 2 способа получения безводной соли Е (укажите условия реакций).
5. Напишите реакции взаимодействия:
a) металла Х с монооксидом углерода;
b) соли Е с водным раствором аммиака и хлорида аммония на воздухе (NH3 + NH4Cl + O2), если при этом образуется вещество с массовой долей азота 27,94 %;
c) соли Е с водным раствором аммиака и хлорида аммония на воздухе (NH3 + NH4Cl + O2) в присутствии активированного угля, если при этом образуется вещество с массовой долей азота 31,40 %.
(авторы К. А. Куриленко)
Задача 11-3.
На приведённой ниже схеме превращений зашифрованы важные промышленные процессы, используемые для получения различных мономеров.
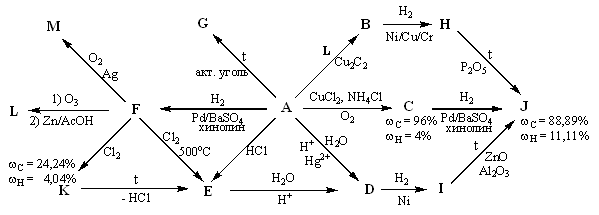
1. Расшифруйте эту схему, учитывая, что на ней отсутствуют коэффициенты.
2. Напишите структуры повторяющихся звеньев полимеров, образующихся при полимеризации соединений E, F, M. Соединения A и J в зависимости от условий полимеризации могут образовывать по два типа регулярных полимеров.
3. Напишите структуры повторяющихся звеньев для каждого из них.
(автор И.В. Трушков)
Задача 11-4.
17 ноября 2009 г. исполнилось 160 лет со дня рождения великого русского химика Е.Е. Вагнера. Его магистерская диссертация была связана с изучением окисления кетонов хромовой смесью при 100°С. Он нашёл, что в этих условиях гексанон-3 превращается в смесь трёх кислот в соотношении 1 : 1 : 1.
1. Напишите структурные формулы образовавшихся кислот и соответствующие уравнения реакций.
2. Укажите, какая из написанных Вами реакций протекает быстрее.
При изучении окисления несимметричных кетонов Вагнер установил, что "При неодинаково гидрогенизированных прикарбонильных атомах углерода окисляется и отщепляется при главном направлении реакции тот из них, который … гидрогенизирован, при второстепенном направлении, наоборот, - … гидрогенизированный."
3. Вставьте пропущенные слова "более" и "менее" в правило, сформулированное Вагнером. Учтите, что сейчас, в отличие от Вагнера, мы знаем, что эта реакция начинается с превращения кетонов в изомерные им енолы, что позволяет предсказывать направление реакции на основании правила А. М. Зайцева, учителя Вагнера в Казанском университете.
При изучении реакции окисления изопропилэтилкетона Вагнер нашёл, что скорость "главной" реакции в 4 раза превышает скорость "второстепенной".
4. Укажите соотношение (по массе) кислот, образующихся в ходе этого процесса.
5. Тем не менее, есть примеры соединений, на которые данное правило не распространяется. Среди приведённых ниже соединений выберите те, для которых правило Вагнера не выполняется. Объясните Ваш выбор.
Список соединений: 2,3,6-триметилгептанон-4; 3-метил-1-фенилбутанон-2;
4-метил-1-фенилпентанон-3; 2,2-диметилпентанон-3.
(автор И.В. Трушков)
Задача 11-5.
Зависимость скорости химической реакции от температуры.
Связь уравнений Вант-Гоффа и Аррениуса
Скорость большинства химических реакций увеличивается с ростом температуры. Для описания зависимости скорости химической реакции от температуры используют различные соотношения.
Одно из таких соотношений - эмпирическое правило Вант-Гоффа, согласно которому при увеличении температуры на 10 градусов скорость гомогенной реакции возрастает в 2-4 раза, т. е. температурный коэффициент скорости реакции g равен
Другое из таких соотношений - уравнение Аррениуса, согласно которому константа скорости реакции описывается следующей формулой:
Вопросы.
1. Подставив уравнение Аррениуса в правило Вант-Гоффа, получите уравнение, связывающее энергию активации реакции и температурный коэффициент скорости.
2. Используя полученное соотношение, рассчитайте диапазон энергий активации, в котором правило Вант-Гоффа выполняется при температурах, близких к комнатной.
3. Покажите, как этот диапазон зависит от температуры. Для этого с помощью полученного соотношения изобразите на одном графике зависимости EA от температуры (в интервале от 0 до 500 К) для g = 2 и g = 4.
(автор С.И. Каргов)
Представлены материалы методических рекомендаций "В помощь оркомитетам, жюри и методическим комиссиям регионального этапа всероссийской олимпиады школьников
по химии",
авт. О.В. Архангельская, и др. ЦМК по химии Всероссийской химической олимпиады школьников, 2009.
"ЦМК убедительно просит раздать каждому участнику олимпиады и их наставникам комплекты заданий и решений всех классов из этого сборника. . Это является прекрасной базой для самостоятельной подготовки школьника не только к последующему этапу текущего года, но и к этапам олимпиады последующих лет."