| Назад Главная страница |
Всероссийская олимпиада школьников по химии 2007-2008 г
|
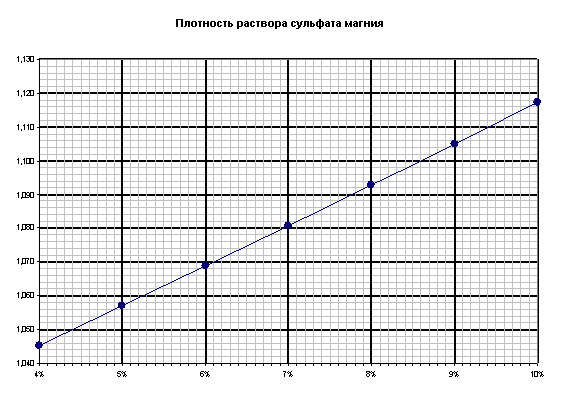
| w(MgSO4) % | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Плотность, г/мл | 1,045 | 1,057 | 1,069 | 1,081 | 1,093 | 1,105 | 1,117 |
В вашем распоряжении лабораторное оборудование для приготовления раствора, весы, ареометр, мерный цилиндр.
На выполнение этого задания Вам отводится 15-20 минут. Если вы справились с ним раньше, сдайте преподавателю отчет по заданию 1 и приступайте к практической работе.
"
- - - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - -
Задание 2.
(Выдается отдельно, после выполнения задания 1)
- На специальном листе бумаги постройте график зависимости плотности раствора сульфата магния от массовой доли соли.
- Отвесьте порцию кристаллогидрата массой около 7-9 г, запишите точное значение массы. Высыпьте навеску соли в колбу. Мерным цилиндром отмерьте 50 мл воды и приготовьте раствор.
- Рассмотрите выданный вам ареометр, определите цену деления прибора, и измеряемый интервал плотностей. Запишите в отчет характеристики прибора с указанием наименований единиц.
- Приготовленный раствор перелейте в чистый мерный цилиндр, аккуратно опустите в раствор ареометр. Прибор должен плавать в растворе, не касаясь стенок цилиндра. Запишите показание ареометра. Выведите ареометр из равновесия, дайте ему снова успокоиться и повторите измерение еще два раза. Все результаты занесите в отчет, найдите среднее значение.
- Используя график, определите значение массовой доли соли в вашем растворе, рассчитайте состав выданного вам кристаллогидрата MgSO4*nH2O. Учтите, что из-за частичного обезвоживания кристаллогидрата величина n может быть дробной, укажите ее значение с точностью до сотых.
- Проведите качественные реакции на ионы соли, отбирая небольшие порции раствора в пробирки. Запишите признаки реакций, их уравнения в ионной форме (если они не были записаны в отчете по заданию 1).
- Одиночный экперимент дает недостаточно надежные результаты. Поэтому, если позволяет время, проведите повторный эксперимент с новой навеской кристаллогидрата и сравните полученные результаты. Если они расходятся, укажите, какой результат вы считаете более точным, или найдите среднее значение.
- Подготовьте свое рабочее место к сдаче преподавателю.
"
- - - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - -
Решение экспериментального тура.
Задание 1. Способ определения, план работы ясны из задания 2. Простейшие качественные реакции на ионы – реакция со щелочью и хлоридом бария:
Mg2+ + 2OH- = Mg(OH)2¯ (белый осадок), и SO42- + Ba2+ = BaSO4¯ (белый осадок).
Задание 2.
График:
Пример вычислений:
Пусть масса масса кристаллогидрата равна 9,27 г, измеренная плотность 1,090 г/мл, массовая доля соли по графику 7,78%.
Тогда, масса раствора равна 59,27 г, масса MgSO4 в нем равна m=m(p)*w = 59,27*0,0778 = 4,61 г, масса воды в пробе кристаллогидрата 9,27-4,61=4,66 г.
Количество вещества n=m/M: m(MgSO4) = 4,61/120 = 0,0384 моль;
m(H2O) = 4,66/18 = 0,259 моль;
n = 0,259/0,0384 = 6,74.
Формула кристаллогидрата MgSO4*6,74H2O (примерно MgSO4*7H2O)
Оценивание:
Задание 1. План работы 3 балла, качественные реакции 2 балла, всего 5 баллов.
Задание 2. График 3 балла, техника работы 5 баллов, расчеты - 5 баллов.
Дополнительные баллы участникам, первым закончившим эксперимент, за проверку надежности результата, при условии правильного выполнения и достаточно полного писания хода работы до 2 баллов
Суммарная оценка: 20 баллов
Реактивы и оборудование:
Рабочее место: линейка, карандаш, мм-бумага, колба 150 мл, стекл. палочка, цилиндр 50 мл, штатив с 2 пробирками, ареометры (1,000-1,060; 1,060-1,120), растворы хлорида бария, гидроксида натрия (выдаются после выполнения задания 1.
Дополнительно: Весы электронные, шпатели, бумага для взвешивания, дист. вода.
Примечания.
Типичные ошибки: неумение грамотно построить график, ошибки в приготовлении растворов (растворение в мерном цилиндре), ошибки в расчетах. Работа с ареометром была отработана на мастер-классе и затруднений не вызвала.
При использовании материалов ссылка на сайт обязательна.
© Можаев Г.М.
kontren.narod.ru
|
|
|
|