Всероссийская олимпиада школьников по химии 2002-2003 г
Областной этап. Экспериментальный тур.
Одиннадцатый класс.
Определение содержания углеводов
Задание 1. Приготовление вытяжки и план анализа.
Если получать гидроксид меди в присутствии калий-натриевой соли винной кислоты (КООС-СНОН-СНОН-СООNa), то он не выпадает в осадок, а образуется ярко-синий раствор, в которой медь присутствует в виде соединения KNa[CuC4H2O6]. Этот раствор (реактив Фелинга) используется для определения содержания углеводов, восстанавливающих медь(II) до оксида меди(I) (метод Бертрана). Выделить и взвесить Cu2O сложно, и его определяют используя окислительно-восстановительные реакции. Содержание углевода устанавливают с помощью специальной таблицы.
Для работы необходимо приготовить вытяжку из растительного сырья. Для этого взвесьте стаканчик с измельченным сырьем, перенесите основную его часть в колбу, и взвесьте стаканчик снова. Запишите обе массы.
В колбу добавьте 100 мл горячей воды и поставьте ее на водяную баню при 70oC на 20-30 минут. Затем охладите колбу и отфильтруйте основную часть раствора через бумажный фильтр в сухую колбу.
Чем можно объяснить образование реактива Фелинга? Какое строение он имеет? Чем объясняются восстанавливающие свойства сахаров? Составьте план анализа, если в Вашем распоряжении кроме фелинговой жидкости имеется подкисленный раствор Fe2(SO4)3 неизвестной концентрации, раствор KMnO4 с известной концентрацией, оборудование для титрования. Напишите схемы предполагаемых реакций.
На выполнение этого задания Вам отводится 20-30 минут. Если вы справились с ним раньше – сдайте отчет и получите у преподавателя задание 2.
"
- - - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - -
Задание 2. Проведение анализа.
(Выдается отдельно, после выполнения задания 1)
Отмерьте пипеткой 10 мл фильтрата и перенесите в колбу для титрования, добавьте 20 мл воды. Прилейте в колбу 20 мл фелинговой жидкости, перемешайте смесь, доведите до кипения и кипятите 1-2 минуты.
Дайте отстоятся полученному осадку 1-2 минуты и осторожно слейте жидкость. Промойте образовавшийся осадок декантацией: прилейте дистиллированной воды, перемешайте и снова слейте жидкость. Главное на этом этапе – не потерять часть осадка!
К промытому осадку добавьте 10-20 капель подкисленного раствора сульфата железа(III), перемешайте до растворения. Подготовьте бюретку для титрования.
Титруйте (небольшими порциями добавляйте раствор KMnO4 при постоянном перемешивании) до появления розовой окраски, запишите объем израсходованного раствора. Если позволяет время, повторите анализ два - три раза, запишите все данные, для расчетов используйте среднее арифметическое сходящихся результатов.
Оформите отчет. В отчете напишите уравнения реакций, и данные титрования: объем пробы – объем раствора. Выведите формулы для расчета: а) массы меди по объему и концентрации KMnO4; б) массовой доли углевода в растительном сырье, учтя его массу (mу) и массу сырья(mс), объем вытяжки (Vвыт) и объем взятой для титрования пробы (Vпр). Проведите необходимые расчеты (масса углевода находится по таблице).
"
- - - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - -
Решение экспериментального тура.
Задание 1. План, схемы реакций ясны из задания 2.
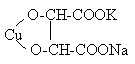
Соль винной кислоты содержит две гидроксо-группы и подобно диолам образует с медью соединение:
Восстановительные свойства сахаров объясняются наличием карбонильной (альдегидной) группы. Схема реакции:
R-CHO + 2 KNa[CuC4H2O6] + 2Н2O => R-COOH + Cu2O+ 2 KNaC4H4O6.
Задание 2.
Уравнения реакций: Cu2O + Fe2(SO4)3 + H2SO4 = 2CuSO4 + 2FeSO4 + Н2O
10FeSO4 + 2KMnO4 + H2SO4 = 5Fe2(SO3)4 + 2MnSO4 + K2SO4 + 8Н2O
Согласно уравнениям n(FeSO4) = 5n(KMnO4), n(Cu2O) = n(FeSO4)/2 = 2,5n(KMnO4),
n(Cu) = 5n(KMnO4) = 5c(KMnO4)V(KMnO4)*10–3
m(Cu) = n*M=63,6*5cV*10–3 г = 63,6*5cV мг
Пусть c(KMnO4)=0,02 моль/л, Vср = 5,5 мл,
тогда m(Cu) = 63,6*5*0,02*5,5 = 35 мг, m(УВ)табл = 17,4 мг в объеме пробы.
Если для анализа взята навеска 2 г, объем вытяжки 100 мл, а объем пробы – 25 мл, получаем следующую формулу для расчета:
w(УВ) = m табл*Vвыт/(10Vпр * mс) = 17,4*100/(10*25*2) = 3,5%
Оценивание:
Задание 1. План анализа, ответы на вопросы, схемы реакций (возможно без коэффициентов) 5 баллов
Задание 2. Отчет 2 балла, техника работы 5 баллов, формулы, расчеты 5 баллов
Дополнительные баллы участникам, первым закончившим эксперимент, за быстроту и аккуратность в работе, при условии правильного выполнения и достаточно полного писания хода работы до 3 баллов
Суммарная оценка: 20 баллов
При использовании материалов ссылка на сайт обязательна.
© Можаев Г.М.
kontren.narod.ru
|