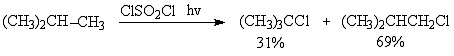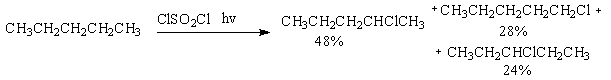|
Областная олимпиада школьников по химии 2006/2007 г. Девятый класс. Задача 9-1. «Многие металлы вытесняют водород при действии на растворы щелочей. Особенно ясно действует в этом отношении алюминий, потому что его окись со щелочами дает раство-римое соединение. Такой способ предложен в России – во время японской войны даже для получения водорода, необходимого для военных аэростатов, потому что остальные (кроме воды) материалы, для него надобные – NaHO и Al – удобны для перевозки и легки.» (Д.И. Менделеев, «Основы химии», т.1, М.-Л., ГХИ, 1947, стр. 415.) 1. Какое вещество во времена Менделеева изображали формулой NaHO? Напишите уравнение реакции получения водорода по описанному способу. 2. Определите минимальную массу реагентов, необходимых для заполнения аэростата с подъемной силой 150 кг (при н.у.). 3. «Многие металлы вытесняют водород при действии на растворы щелочей.» Какие из металлов (помимо алюминия) могли бы быть использованы для получения водорода таким путем? Приведите уравнения реакций (два примера). 4. Возможно ли использование других “материалов” с большим выходом водорода на единицу транспортируемой массы? (Приведите два примера реакций: а) с участием алюминия; б) с участием веществ других классов химических соединений.) (автор А.И.Жиров) Задача 9-2. При промышленном получении серной кислоты SO2 окисляют до SO3, который поглощают серной кислотой (в первой поглотительной башне) с образованием олеума. Олеум можно рассматривать как раствор SO3 в серной кислоте. 1. Напишите уравнение реакции окисления SO2 в SO3, охарактеризуйте особенности данной реакции и обоснуйте условия ее протекания. 2. Растворение SO3 в серной кислоте сопровождается образованием ряда веществ, легко переходящих друг в друга. Образованию какого соединения отвечает олеум с содержанием SO3 ~45% (формула)? Напишите структурную формулу этого соединения. 3. В вашем распоряжении имеется 30%-ный олеум. В каком весовом соотношении следует его смешивать с водой, чтобы получить 40% раствор H2SO4 в воде (аккумуляторная серная кислота – используемая в свинцовых автомобильных аккумуляторах). 4. В каком весовом соотношении надо смешивать воду и 30%-ный олеум для получения безводной серной кислоты? Определите до какой температуры может нагреться образующаяся кислота, если тепловой эффект взаимодействия воды и SO3 составляет 89,37 кДж/моль, а теплоемкость серной кислоты 138,9 Дж/мольК (начальную температуру принять 25 oС, потерями теплоты можно пренебречь). (автор С.А.Серяков) Задача 9-3. «Глава 13. Что есть живое серебро, и каково его происхождение … Оно источник всех металлов, как уже отмечено мною раньше. Все металлы сотворены из него. Оно смешивается с железом, и ни один металл не может быть озолочен без помощи живого серебра. Прибавлю еще. Живое серебро и сера, если их подвергнуть возгонке с нашатырем, обратятся в сверкающий красный порошок. Когда же этот порошок сгорает в пламени, он вновь возвращается к прежнему состоянию»… Альберт Великий “Малый алхимический свод” XIIIв. 1. Что такое «живое серебро»? Ответ подтвердите расчетами. “Живое серебро” часто можно встретить в природе в виде сульфидов. Напишите уравнение реакции получения этого металла из сульфида. 2. Как называются сплавы, содержащие “живое серебро”. Рассчитайте, сколько атомов “живого серебра” приходится на атом калия в сплаве, если максимальное содержание калия составляет 0,8% по массе. Напишите уравнение реакции этого сплава с водой. 3. При взаимодействии “живого серебра” с азотной кислотой может образоваться либо азотнокислая окись “живого серебра” (содержание “живого серебра” 61,84%), либо азотнокислая закись “живого серебра” (масса одного моля 526 г.) (Все данные в расчете на безводную соль). Напишите уравнения реакций. 4. Окислители легко переводят соединения закиси “живого серебра” в производные окиси. Напишите уравнение реакции хлорида закиси “живого серебра” (каломели) с хлором. 5. Восстановители легко переводят соединения окиси “живого серебра” в производные закиси. Напишите уравнение реакции хлорида металла с оксидом серы (IV) в растворе. (авторы Ф.Н.Новиков, О.В.Матусевич) Задача 9-4. 
(авторы Ф.Н.Новиков, О.В.Матусевич) Задача 9-5. Медицинский препарат 1 называется «…. магния» состоит из двух бинарных веществ А и Б одинакового качественного состава. Нагревание препарата 1 сопровождается выделением бесцветного газа, поддерживающего горение, и потерей массы 4,29%. При этом образуется препарат 2 – «… магния», состоящий исключительно из Б. Оба препарата используются для лечения заболеваний желудочно-кишечного тракта, причем 1 оказывает активное противомикробное действие, в отличие от 2. При растворении Б в серной кислоте и последующей кристаллизации продукта получается вещество В, исторически используемого в качестве легкого слабительного средства. Массовый состав В: 5,7% H, 71,5% O, 13,0% S, 9,8% Mg. 1. Определите состав веществ А и Б и приведите названия препаратов 1 и 2, учитывая, что название 1 – название соединения А, а название 2 – название соединения Б. 2. Установите состав препарата 1 (массовые %) и химическую формулу вещества В и его название. 3. Рассчитайте, сколько г вещества В можно получить при насыщении 100 г 30% серной кислоты веществом Б при нагревании и кристаллизации раствора при 20оС, если растворимость вещества В составляет при этой температуре 35,1 г на 100 г воды. 4. С чем может быть связана противомикробная активность 1? Каково может быть медицинское действие препарата 2? (автор С.А.Серяков) Областная олимпиада школьников по химии 2006/2007 г. Десятый класс. Задача 10-1. После растворения смеси хлорида бария и сульфата натрия в воде оказалось что: а) масса осадка в 3 раза меньше массы солей в фильтрате (растворе); б) масса осадка в 3 раза больше массы солей в фильтрате (растворе). Определите массовые доли солей в исходной смеси, если известно, что в фильтрате отсутствуют ионы бария. 1. Какие соли будут находиться в растворе? 2. Проанализируйте условия а) и б) на химическую корректность. 3. В случае корректности условия решите задачу. 4. Как можно изменить химическую сторону задачи, чтобы для того же осадка некорректное условие стало корректным? (автор О.В.Архангельская) Задача 10-2. К водным растворам хлоридов калия, магния, кальция, алюминия, меди(II) и железа(III) прилили водный раствор карбоната натрия. В пяти пробирках наблюдалось выпадение осадка, в трёх – выделение газа. 1. Напишите уравнения происходящих реакций. Чем можно объяснить различное протекание реакции?. 2. В каком случае при кипячении раствора, полученного после отделения осадка, происходит выделение дополнительного количества газа и выпадение осадка другого состава, чем первоначальный? 3. На чем основано использование питьевой соды в кулинарии, в медицине? 4. Можно ли использовать для полоскания горла раствор питьевой соды, растворённой в кипятке и затем охлажденный? (авторы А.А.Антонов, А.А.Дроздов) Задача 10-3. 1. Вычислите стандартную теплоту сгорания нафталина (C10H8), если стандартные теплоты образования нафталина, воды и оксида углерода(IV) равны соответственно: –75,8; 285,8; 393,5 кДж/моль. 2. Какое количество теплоты выделится при сгорании 20 г нафталина? 3. Оцените, до какого значения повысится температура 1,5 л воды с температурой 25oC, если ей передать все количество теплоты, выделившееся при сгорании 20 г нафталина? 4. Какова структурная формула нафталина? Будет ли раствор этого вещества реагировать с бромной водой? С концентрированной серной кислотой? (автор И.А.Тюльков) Задача 10-4. Выход продуктов при радикальном хлорировании алканов зависит от числа атомов водорода, способных замещаться (статистический фактор) и от скорости замещения атомов водорода при первичном, вторичном или третичном атоме углерода. При этом скорости реакции не зависят от длины и структуры углеродного скелета. 1. По представленному ниже составу продуктов радикального хлорирования, проведенного при помощи сульфурилхлорида (SO2Cl2), заполните таблицу и рассчитайте соотношение скоростей реакций замещения водорода на галоген у первичного, вторичного и третичного атомов углерода (относительную реакционную способность).
Таблица:
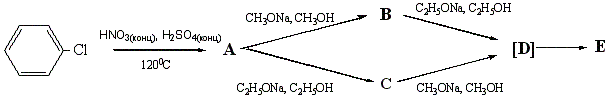
2. Напишите схему реакции радикального хлорирования 2,4- диметилпентана и предскажите процентное содержание каждого из возможных монохлорзамещенных продуктов в их смеси, полученной при этой реакции. (автор В.И. Теренин) Задача 10-5. В своих популярных Рождественских лекциях М.Фарадей для идентификации продуктов горения свечи использовал «…химическое вещество, открытое сэром Гемфри Деви; оно очень энергично действует на воду, и это воздействие будет служить нам для обнаружения воды. Вещество это называется …. достаточно взять маленький кусочек его и бросить в чашку с водой; как только оно попадет на воду, так сейчас же вспыхивает…». Более ста лет назад И.Либих наблюдая роль … и фосфора в растениях, сказал: «Без этих двух элементов не может быть плодородия наших полей». 1. Какое вещество открыл сэр Г.Деви? Напишите реакцию этого вещества с водой. 2. Из какого соединения и каким образом выделил Г.Деви это вещество? Напишите уравнение реакции. (Если не знаете о работах Г.Деви, предложите свой способ получения) 3. В виде каких соединений вещество, открытое Г.Дэви, встречается в природе и где, по Вашему мнению, в нашей стране находятся основные залежи его минералов, имеющие промышленное значение? Какой может быть окраска минералов и почему? 4. Содержание этого питательного элемента в удобрениях определяют в расчете на условное содержание его оксида. Определите, выше какого значения не может быть услов-ное содержание оксида в хлориде этого вещества (элемента). 5. Напишите уравнение реакции этого вещества с газообразным и с жидким аммиаком. (автор О.К.Лебедева) Областная олимпиада школьников по химии 2006/2007 г. Одиннадцатый класс. Задача 11-1. Бесцветная прозрачная жидкость А, содержащая 8,3% водорода, 32,7% хлора и кислород, при нагревании до 110oС выделяет газ Х. После того, как потеря массы жидкости А составит 16,8%, при 110oС перегоняется однородная жидкость В постоянного состава (азеотропная смесь). При охлаждении жидкости А ниже 0oС сначала выделяются кристаллы Y, не содержащие хлор, а при более сильном медленном охлаждении (вымораживание) выделяются кристаллы С, содержащие до 65% хлора по массе. Плавление кристаллов С сопровождается частичным выделением того же газа Х. Вопросы: 1. Что собой представляют жидкости А и В, вещества С, Х и Y? Ответ подтвердите расчетами. 2. Объясните, почему при плавлении кристаллов С частично выделяется газ Х. 3. Напишите уравнения необратимых реакций жидкости В с тремя неорганическими и двумя органическими соединениями, принадлежащими к разным классам веществ. (автор С.С.Чуранов) Задача 11-2. После растворения смеси хлорида бария и сульфата натрия в воде оказалось, что: а) масса осадка в 3 раза меньше массы солей в фильтрате (растворе); б) масса осадка в 3 раза больше массы солей в фильтрате (растворе). Определите массовые доли солей в исходной смеси, если известно, что в фильтрате отсутствуют ионы бария. 1. Какие соли будут находиться в растворе? 2. Проанализируйте условия а) и б) на химическую корректность. 3. В случае корректности условия решите задачу. 4. Как можно изменить химическую сторону задачи, чтобы для того же осадка некорректное условие стало корректным? (автор О.В.Архангельская) Задача 11-3. При нитровании хлорбензола смесью концентрированных азотной и серной кислот при нагревании происходит образование соединения А, имеющего три типа атомов водорода (по данным спектров ЯМР 1Н). Обработка А метилатом натрия в метаноле приводит к образованию B, а при обработке А этилатом натрия в этаноле образуется соединение C. Растворение B в этаноле и C в метаноле и выдерживание полученных растворов в течение длительного времени в присутствии каталитических количеств соответствующих алкоголятов приводит к образованию смесей E одинакового качественного, но разного количественного состава. При изучении механизма этих процессов было обнаружено, что в обоих случаях образуется одно и то же промежуточное соединение D. Превращения А представлены на схеме:
1. Изобразите структуры А, B, C и D, укажите качественный состав E. 2. Напишите, какое ароматическое соединение будет преобладать в смеси E при ее получении: а) из B; б) из C. 3. Соединение А в присутствии влаги обладает раздражающим действием на слизистые оболочки. Объясните это явление, ответ подтвердите уравнением реакции. (автор М.Д.Решетова) Задача 11-4. В середине прошлого века специалистами компании «Дюпон» был разработан промышленный метод синтеза вещества F-11, оказавшегося полезным в различных областях техники. В последующие годы были синтезированы и изучены еще несколько десятков веществ, «похожих» на F-11, большинство из которых также обладали рядом ценных свойств. В связи с большим количеством и широкой распространенностью соединений типа F-11 было принято решение создать для этих соединений собственную номенклатуру, которая на данный момент стала для них общепринятой. Некоторые данные соединений (в соответствии с атомными массами с точностью до второго знака после запятой) приведены в таблице:
Все вещества, приведенные в таблице, являются производными насыщенных углеводородов. При 25oС все вещества - бесцветные газы, устойчивые на воздухе. Термолиз (или импульсный фотолиз) F-23 и F-14 приводит к одному и тому же продукту – очень реакционноспособной частице A, которая может существовать как в триплетном, так и в более устойчивом синглетом состоянии. 1) Приведите состав всех соединений, упомянутых в тексте задаче. 2) Приведите схему синтеза любых двух соединений из таблицы. 3) Приведите схему реакции термолиза соединений F-23 и F-14, название соединения A. 4) Где применяются описанные соединения? 5) Приведите собирательное название веществ, указанных в таблице. 6) В соответствии с международным Монреальским протоколом, вступившим в силу 1.01.1989 г, производство большинства описанных в задаче соединений было значительно снижено к 1990 г и полностью прекращено к 2005г. Это нанесло серьезный удар по некоторым отраслям промышленности и повлекло за собой значительные материальные убытки. Как вы думаете, в чем причина столь радикального решения? (автор А.М.Мажуга) Задача 11-5. Большая часть фундаментальных химических законов тесно связана с достижениями квантовой физики, термодинамики и кинетики. Многие из этих законов знакомы вам из школьных учебников химии и физики. 1. Подберите каждому из уравнений (I колонка) соответствующее описание (II колонка) и автора (первооткрывателя) с чьим именем (именами) связано уравнение (III колонка).
*) Тн – температура нагревателя; Тx – температура холодильника. 2. Назовите шесть обладателей Нобелевской премии, представленных в колонке III. 3. Какую размерность имеют в Международной системе измерения физических величин СИ (System International) следующие величины, использованные в уравнениях: h, R, M. Основные величины СИ: длина [м], время [c], масса [кг], количество вещества [моль]. Примеры: сила [Н = кг•м/с2], энергия [Дж = Н•м = кг•м2/с2]. (автор С.А.Серяков) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Представлены несколько переработанные материалы пособия: |