|
Назад
Олимпиада
9 класс
10 класс
11 класс
|
Всероссийская олимпиада школьников по химии 2006/2007 г
Областной этап. Экспериментальный тур.
Одиннадцатый класс.
.
Распознавание органических веществ.
Синтез и хроматографический анализ смеси.
Задание 1. В выданных вам пронумерованных пробирках находятся вещества: пентан,
1-хлорпентан, уксусная кислота, глицерин, пропанол, глюкоза (часть веществ в виде растворов).
В качестве реактивов: медь, вода, растворы гидроксида натрия и сульфата меди.
Составьте план работы определения веществ в пробирках по их физическим и химическим свойствам, напишите уравнения возможных реакций, опишите признаки их протекания.
Каким образом, используя имеющиеся вещества, можно получить вещество со общей формулой C5H10O2, относящееся к еще одному классу органических веществ? Напишите уравнение возможной реакции, условия ее протекания.
На выполнение этого задания Вам отводится 30-40 минут. Если вы справились с ним раньше, сдайте преподавателю отчет по заданию 1 и приступайте к практической работе.
"-
- - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - -
Задание 2. (Выдается отдельно, после выполнения задания 1)
По физическим и химическим свойствам распознайте предложенные вещества. В отчете опишите ход работы, наблюдения, уравнения реакций, выводы.
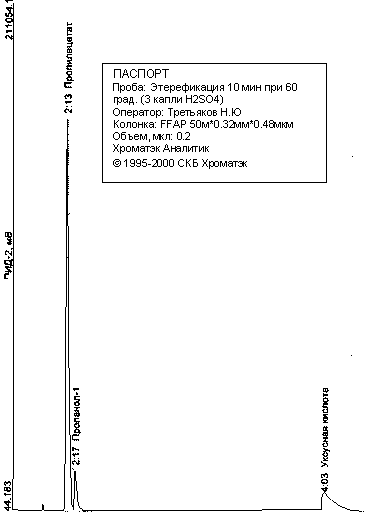
Задание 3. Синтез вещества и анализ смеси. Из склянок под определенными номерами отмерьте в чистую пробирку 1 мл спирта, добавьте и 1 мл ледяной уксусной кислоты, добавьте 1 каплю концентрированной серной кислоты (ОСТОРОЖНО! Едкие вещества!). Осторожно перемешайте, закройте пробирку пробкой с трубкой-холодильником и поставьте в водяную баню на 15 мин. После охлаждения сдайте смесь на хроматографический анализ. После анализа в реакционную смесь добавьте 2-3 мл насыщенного раствора хлорида натрия, перемешайте. Отметьте растворимость-нерастворимость полученного вещества, характерный запах.
По полученной хроматограмме рассчитайте примерный выход продукта, учтя что площади пиков на хроматограмме пропорциональны количествам вещества. В отчете опишите ход работы, наблюдения, уравнения реакций, название и класс полученного вещества (если это не было описано в части 1), расчеты.
"-
- - - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - -
Решения экспериментального тура.
Задание 1. План работы может быть следующим:
- Определение растворимости и примерной плотности веществ. В пробирку с 2-3 мл воды добавляют несколько капель испытываемой жидкости и перемешивают. Отмечают растворение или разделение слоев в пробирке. Из представленных веществ нерастворимы пентан и 1-хлорпентан. Алканы легче воды, их галогенпроизводные как правило тяжелее.
- Проба на галоген. Медная проволочка, смоченная исследуемым веществом, при наличии галогена окрашивает пламя спиртовки в зеленый цвет (проба Бельштейна).
- Испытание оставшихся растворов гидроксидом меди.
В пробирку наливают около 1 мл раствора NaOH, несколько капель раствора сульфата меди, и к полученному синему осадку приливают 1-2 мл исследуемой жидкости. Наблюдают изменения происходящие на холоду и при нагревании:
| Вещество |
уксусная к-та |
глицерин |
пропанол |
глюкоза |
| На холоду |
бледно-голубой
раствор |
синий раствор |
Без изменений |
синий раствор |
| При нагревании |
Без изменений |
Без изменений |
Осадок чернеет |
Красно-оранж.
осадок |
Уравнения реакций:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2CH3COOH = Cu(CH3COO)2 + 2H2O
Cu(OH)2 + 2C3Н5(OH)3 = Cu(C3Н5(OH)2O)2 + 2H2O
Cu(OH)2 + 2CH2OH(CHOH)4CHO = Cu(C6H11O6)2 + 2H2O
При нагревании в пробирке с пропанолом: Cu(OH)2 = CuO + H2O
В пробирке с раствором глюкозы
2Cu(OH)2 + CH2OH(CHOH)4CHO = Cu2O + CH2OH(CHOH)4COOH + 2H2O
Формулу C5H10O2 может иметь сложный эфир, пропилацетат, который получают взаимодействием уксусной кислоты и пропанола (реакция протекает при нагревании, в присутствии катализатора – серной кислоты):
C3Н7OH + CH3COOH = CH3COOC3Н7 + H2O
Для количественного определения содержания веществ по хроматограмме обычно используется площадь пика данного вещества, которую можно приближенно оценить по формуле площади треугольника: S=ah/2, где а – основание, h – высота пика (Или S=bh, где b – ширина пика на половине высоты).
Пусть при обработке хроматограммы получены следующие данные:
| Вещество |
пропанол |
уксусная к-та |
эфир |
| S см2 |
7,5 |
8,2 |
6,4 |
Поскольку площади пропорциональны количествам вещества, эти числа можно записать
как количества вещества и использовать для расчета по уравнению: |
| n, моль (после реакции)
|
7,5 |
8,2 |
6,4 |
| n, моль (до реакции)
|
13,9 |
14,6 |
0 |
Судя по уравнению реакции, уксусная кислота в избытке, и теоретически должно было получиться 13,9 моль эфира. Выход реакции = nпр/ nтеор = 6,4/13,9=0,46 = 46%
Оценивание:
Задание 1. Растворимость – 1 балл, обнаружение галогенов 1 балл, отношение к гидроксиду меди 3 балла. Получение эфира 1 балл, условия реакции 1 балл. Всего 7 баллов.
Задание 2-3. Техника работы 5 баллов, за каждое верно определенное вещество по 0,5 балл – 3 балла, расчет выхода – 3 балла, описание наблюдений и свойств продукта 5 баллов.
Дополнительные баллы участникам, первым закончившим эксперимент, за быстроту и аккуратность в работе, при условии правильного выполнения и достаточно полного описания хода работы до 2 баллов.
Суммарная оценка 25 баллов.
Вообще то уксусная кислота легко определялась по запаху (тем не менее один из участников перепутал ее с ... пропанолом. Ошибка оказалась не критичной, поскольку эфир был все же получен).
Многих подвела хорошо известная реакция окисления спирта оксидом меди (посветление медной проволочки, покрытой оксидом). Но что хорошо протекает с чистым спиртом, не всегда также характерно для его раствора. Кроме того, здесь посветление проволочки могло наблюдаться и при опускании ее в раствор уксусной кислоты, в раствор глюкозы... Вероятно поэтому у части участников раствор глюкозы и был перепутан с раствором спирта.
Иногда в качестве качественной реакции выбирались процессы никак не подходящие для этой цели. Например: "При нагревании хлорпентана с раствором щелочи произойдет образование спирта и растворение органического слоя". Во-первых, нагревать пришлось бы родолжительное время, с обратным холодильником, во-вторых, не так уж хорошо растворим пентанол.
Плоховато обстояло дело и с анализом физических свойств алканов, их галоген-производных. Встречались утверждения: "В пробирке 2 тяжелая жидкость, значит это пентан.." А вот медный глицерат действительно оказался хорошим знакомым для практически всех участников, и по внешнему виду, и по строению.
У некоторых участников была сделана попытка оценить выход продукта по высоте пиков хроматограмме, но в целом этот метод исследования оказался для многих новым.
А всегда полезно узнать что-то новенькое..
Можаев Г. М., старший преподаватель
Тюменского государственного университета
|
