|
Областная олимпиада школьников по химии 2006/2007 г. Решения задач, девятый класс.
Представлены несколько переработанные материалы пособия: Задача 9-1. 1. Вещество - гидроксид натрия, можно представить разные варианты уравнения реакции: 2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2↑ или 6NaOH + 2Al + 6H2O = 2Na3[Al(OH)6] + 3H2↑ (в избытке щелочи) или 2NaOH + 2Al + 10H2O = 2Na[Al(OH)4(H2O)2] + 3H2↑ При любой форме записи на 2 моль алюминия выделяется 3 моль водорода, но масса гидроксида натрия минимальна в первой или третьей реакции. 2. Подъемная сила (закон Архимеда) численно равна (в Граммах) массе вытесненного газа (или жидкости) минус масса тела погруженного в эту среду. Для 1 моль водорода при н.у. 29 – 2 = 27(Г/моль). Для заполнения аэростата потребуется 150кГ : 27Г/моль = 5,56 кмоль водорода. На его получение потребуется 40*2*5,56/3 = 148,3 кг NaOH и 27*2*5,56/3 = 100 кг алюминия. (Общая масса 248,3 кг). 3. Это должен быть активный металл, стоящий в ряду напряжения значительно левее водорода, гидроксид которого растворяется в водном растворе щелочи, т.е. – амфотерный. 2NaOH + Be + 2H2O = Na2[Be(OH)4] + H2↑ 2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2↑ Однако выход водорода по массе исходных реагентов будет меньше даже в случае бериллия, т.к. в реакции расходуется больше щелочи. 4. Возможна замена гидроксида натрия на LiOH (Mr = 24). Тогда щелочи для заполнения аэростата потребуется 24*2*5,56/3 = 89 кг и общая масса составит 189 кг. 2LiOH + 2Al + 3H2O = Li[Al(OH)4] + 3H2↑ Если исключить использование металлического алюминия, для получения водорода, то можно использовать щелочные и щелочноземельные металлы и их гидриды (или комплексные гидриды: LiAlH4). Наиболее оптимальным для получения водорода в полевых условиях может быть, например, гидрид кальция – CaH2 (выбор определяется и скоростью взаимодействия с водой): CaH2 + 2H2O = Ca(OH)2 + 2H2↑ Масса гидрида кальция, необходимая для заполнения аэростата, составляет 42*5,56/2 = 117 кг. (10 баллов) Автор задачи предлагал еще в качестве решения получение водорода из метана. Тогда почему бы не получать его из воды (масса которой вообще не учитывается)? Проблема в трудности осуществления данных реакций в полевых условиях.
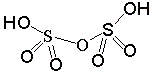
Средний балл 2,75, максимальный балл - 6, нет решения у 1 участника. Задача 9-2. 1. Уравнение реакции окисления: 2SO2 + O2 ↔ 2SO3 + Q. Реакция экзотермическая, обратимая, каталитическая. Судя по уравнению реакции, для смещения равновесия вправо ее следует проводить при повышенном давлении и при возможно низкой температуре. Однако при слишком низкой температуре не будет работать катализатор, и скорость реакции будет мала. Приходится выбирать «золотую середину». 2. В 45%-ном олеуме на 45 г SO3 приходится 55 г серной кислоты. Молярные отношения: n(SO3) : n(H2SO4) = 45/80:55/98 = 1:1 Значит формулу вещества можно записать как H2SO4*SO3 или H2S2O7 (дисерная или пиросерная кислота). Структурная формула: 3. При внесении олеума в воду протекает следующая реакция: SO3 + H2O = H2SO4 Весь содержащийся в олеуме SO3 превратится в серную кислоту. В 100 г 30% -ного олеума содержится 30 г (0,375 моль) SO3, для реакции потребуется 0,375 моль воды (6,75 г). Общая масса серной кислоты составит 106,75 г. Масса 40%-ного раствора составит 106,75/0,40 = 266,9 г. Значит всего надо добавить воды 266,9 – 100 = 166,9 г. Соотношение масс олеума и воды будет равно 1 : 1,67 4. В этом случае вода необходима только для протекания реакции. Как уже было рассчитано на 100 г 30% -ного олеума потребуется 0,375 моль воды (6,75 г). Т.е. олеум заданного состава нужно смешивать с водой в весовом соотношении 14,8 : 1. Теплоты в реакции выделится Q = QM*n = 89,37*0,375 = 33,51 кДж.
В то же время Q = СM*n(H2SO4)*Δt, где СM - молярная теплоемкость. Отсюда повышение температуры Δt = Q/(СM*n(H2SO4)). (10 баллов) Здесь тоже немногие смогли использовать понятие теплоемкости, трудным оказалось также определение строения дисерной кислоты.. Средний балл 1,88, максимальный балл - 6, нет решения у 3 участников. Задача 9-3. 1. Сначала определим, с каким металлом мы работаем. Известно, что металл имеет две степени окисления (присутствуют закись и окись). Если названия “живое серебро” и “каломель”, а также содержания алхимического текста ни о чем не говорят, то придется проводить расчеты. Нитрат металла не в низшей степени окисления содержит 61,84% металла. Следовательно, массовая доля нитрат-ионов в соли Me(NO3)n равна 38,16%. Молярная масса соли М(с)=62n/0,3816, а металла М(Me)=62n/0,3816 – 62n = 100,5n. 2. Сплавы ртути называются амальгамами. Отношение чисел атомов равно отношению количеств вещества. В 100г сплава содержится 0,8 г (0,021моль) калия и 99,2 г (0,492 моль) ртути. Тогда на атом калия приходится примерно 0,492/0,021=23,5 атомов ртути. 3. Определим состав нитрата закиси ртути. Т.к. масса одного моля 526 г, то единственно возможный вариант – Hg2(NO3)2. Уравнения реакций ртути с азотной кислотой: 4. Переход хлорида ртути(I) (каломель) в хлорид ртути(II) (сулему): 5. Переход ртути(II) в ртуть(I) под действием восстановителя: (10 баллов) То, что речь идет о ртути, определили практически все.. - кто дал решение задачи. Средний балл 1,91, максимальный балл - 6, нет решения у 5 участников. Задача 9-4. 1. По описанным свойствам легко определяется, что вещество В - это хлор, а вещество З – иод. Получить хлор действием окислителя (KMnO4) можно только из соединений с более низкой степенью окисления хлора. Поскольку А газ - это хлороводород, а Б – хлорид натрия. Вещество Е, из которого получают иод действием окислителя (Fe3+) содержит иод в степени окисления -1. Логично предположить, что это иодид, например иодид натрия. Под действием хлора в щелочной среде из него получется Г. Г может окисляться (под действием хлора), восстанавливаться (под действием K2SO3), и дает осадок с хлоридом бария. Значит, в этом соединение иод находится в некоторой положительной, но не высшей, степени окисления. К тому же это вещество дает осадок с хлоридом бария. Такой промежуточной устойчивой степенью окисления иода может быть +5. Тогда Г – NaIO3; Д - NaIO4; Ж – Ba(IO3)2. 2. Уравнения реакций: 2HCl + 2NaOH = 2NaCl + H2O Получение хлора: 16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O Получение иодата натрия: 3Cl2 + NaI + 6NaOH = 6NaCl + NaIO3 + 3H2O Получение периодата (орто-периодата) натрия и его реакция с BaCl2: 2NaIO3 + Cl2 + 2NaOH = 2NaIO4 + 2NaCl + H2O или 4NaOH + NaIO3 + Cl2 = Na3H2IO6 + 2NaCl + H2O 2NaIO3 + BaCl2 = 2NaCl + Ba(IO3)2↓ Восстановление иодата (эффективнее протекает в кислой среде): NaIO3 + 3K2SO3 = NaI + 3K2SO4 При окислении NaI с помощью Fe3+ выделяется «черно-серые кристаллы с фиолетовым металлическим блеском» – I2. 2NaI + 2FeCl3 = 2FeCl2 + 2NaCl + I2 (10 баллов) Камнем преткновения стали кислородные соединения йода. Сказалась и инерция мышления - если барий и осадок, то непременно ищем сульфат бария.. Средний балл 3,33, максимальный балл - 9, нет решения у 2 участников. Задача 9-5. 1. При термическом разложении бинарного соединения выделяется простое вещество, газ, поддерживающий горение – кислород. Тогда Б – MgO, а А – MgO2, Названия препаратов: 1 – пероксид (перекись) магния, 2 – оксид (окись) магния. 2. Препарат 1 – смесь оксида и пероксида магния, при нагревании протекает реакция: 2MgO2 = 2MgO + O2↑ Найдем соотношение количеств вещества элементов в веществе В: Соотношение магния и серы показывает, что при растворении MgO в H2SO4 образуется сульфат магния. То, что при кристаллизации получено вещество, содержащее водород, говорит, что вещество В, скорее всего кристаллогидрат: MgSO4*nH2O, отношение количества вещества магния и водорода показывает, что n=7. Итак, B – MgSO4*7H2O. (Семиводный сульфат магния или гептагидрат сульфата магния). 3. Уравнения реакций MgO + H2SO4 = MgSO4 + H2O; (MgSO4 + 7H2O = MgSO4*7H2O↓) В 100 г 30%-ной серной кислоты содержится 30 г H2SO4 (0,306 моль) и 70г воды. Следовательно, растворится 0,306 моль MgO (12,24 г). Горячий раствор (массой 112,24 г) содержит 0,306 моль MgSO4 (36,73 г) и 70 + 18*0,306 = 75,5 г воды. Пусть х моль MgSO4*7H2O кристаллизуется при 20oС. Тогда масса оставшегося раствора составит (112,24-246x) г, из раствора уйдет 120х г MgSO4 и останется в растворе (36,73 – 120х) г MgSO4. По данным растворимости, массовая доля соли в полученном растворе равна 35,1/(100+35,1) = 0,26 (26%) Получаем уравнение: (112,24-246x)*0,26 = 36,73 – 120х ; откуда x = 0,135 (моль); масса кристаллогидрата: 246х = 33,2 г 4. Препарат 1 содержит MgO2, который в кислой среде желудка образует пероксид водорода, проявляющий бактерицидную активность: MgO2 + 2HCl = MgCl2 + H2O2 Препарат 2 служит антацидным средством, устраняя повышенную кислотность MgO + 2HCl = MgCl2 + H2O (10 баллов) Что казалось бы может быть проще магния и кислорода? Возможно, сил уже не оставалось на последнюю задачу... Средний балл 1,52, максимальный балл - 8, нет решения у 5 участников. |
|
|
Можаев Г. М., старший преподаватель |