|
Областная олимпиада школьников по химии 2006/2007 г. Решения задач, деcятый класс.
Представлены несколько переработанные материалы пособия: Задача 10-1. 1. Уравнение реакции:
Na2SO4 + BaCl2 = BaSO4↓
+ 2NaCl 2. Минимальное количество солей в растворе будет в том случае, когда соотношение исходных веществ отвечает уравнению реакции. При этом на 1 моль BaSO4 (233 г) будет приходиться 2 моль NaCl (117 г), то есть масса осадка будет примерно лишь в два раза боль-ше массы соли в растворе. Поэтому условие б) – не корректно. 3. Решение задачи для условия а):
По условию задачи получаем уравнение: 3*233y = 142(x–y) + 117y; 724y = 142x; y =0,196x m(исх.см.) = 142x + 208у = 142x + 208*0,196x = 182,8x w(Na2SO4) = 142x/182,8x = 0,777 = 77,7% w(BaCl2) = 40,8x /182,8x = 0,223 = 22,3% 4. Чтобы условие б) стало корректным, необходимо, чтобы масса соли в растворе стала меньше массы осадка в три раза. Для одновалентного металла: Me2SO4 + BaCl2 = BaSO4↓ + 2MeCl, M(MeCl) < (233/3)/2 = 38,8, Ar(Me) < 3,3 Металлов с такой атомной массой или значением эквивалента (Ar/валентность) нет. Однако условие б) может стать корректным, если вместо средней соли взять кислую, например: NaHSO4 + BaCl2 = BaSO4↓ + NaCl + HCl; m(BaSO4)/m(NaCl) =233/58,5 = 3,98:1 (10 баллов) К выводу о некорректности условия б) можно было прийти составив и попытавшись решить алгебраическое уравнение по этому условию. Средний балл 2, максимальный балл - 8. Задача 10-2. 1. Реакция солей с карбонатами осложняется протеканием гидролиза, степень которого тем больше, чем слабее соответствующее основание. Расположим катионы по силе соответствующих им оснований: K+> Ca2+ > Mg2+ > Cu2+ >Al3+ ~ Fe3+ Реакции с хлоридом калия протекать не будет. Ca(OH)2 – сильное основание, гидролиз по катиону не идет: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl. Соли магния и меди образуют основные карбонаты: Верными можно считать любые основные карбонаты. Сейчас считается, что в осадок выпадает Mg5(CO3)4(OH)2•4H2O. Mg(HCO3)2 остается в растворе. 2CuCl2 + 2Na2CO3 + H2O = Cu(OH)2•CuCO3↓ + 4NaCl + CO2↑ При реакции солей алюминия и железа(III) протекает полный гидролиз: 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2↑ 2FeCl3 + 3Na2CO3 + 3H2O = Fe(OH)3↓ + 6NaCl + 3CO2↑ Получающиеся осадки представляют собой гели состава Me2O3•xH2O (где Me = Al или Fe, x=1-5) с небольшим количеством карбонат-анионов включенных в структуру. При старении осадка образуются оксогидроксиды MeOOH. 2. В случае хлорида магния: Mg(HCO3)2 = MgCO3↓ + CO2↑ + H2O 3. Использование в кулинарии основано на «гашении» гидрокарбоната уксусной кислотой с выделением углекислого газа, что придает выпечке пышность. В медицине питьевую соду используют для нормализации кислотности желудочного сока (при изжоге). 4. Нет, т.к. гидрокарбонат разлагается при температуре 70-80oС и в растворе будет сильно щелочной раствор карбоната натрия. 2NaHCO3 = Na2CO3 + CO2↑+ H2O (10 баллов) А, казалось бы, простая реакция.. Средний балл 2,9, максимальный балл - 5,8, нет решения у 1 участника. Задача 10-3. 1. Уравнение реакции: C10H8(тв) + 7О2(г) = 10CO2(г) + 4H2O(ж) + Qр-ции Согласно закону Гесса: 2. Q = Qр-ции*n; n(C10H8) = 20/128 =0,16 моль, следовательно, при сгорании 20 г нафталина выделится 5154*0,16 = 805,3 кДж теплоты. 3. Теплоемкость воды с = 4,184 Дж/г*градус. Учитывая, что Q = cm*Δto и считая плотность воды 1 г/мл, можно рассчитать, на сколько градусов должна увеличиться температура 1,5 л воды: Δto = 805,3/(4,184*1500) = 128o Однако, при стандартных условиях вода закипает при 100oC, поэтому температура воды максимально повысится до 100oC 4. Нафталин - ароматический углеводород, с двумя конденсироваными бензольными кольцами. Для ароматических углеводородов не характерны реакции присоединения (реакция с бромной водой не пойдет), но характерны реакции электрофильного замещения. Так, под действием концентрированной серной кислоты идет реакция сульфирования с образованием α-нафталинсульфокислоты: 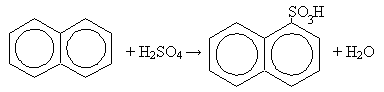
(10 баллов) Представление о законе Гесса есть, но не совсем уверенное, обычный термохимический расчет не вызывает затруднений, многие правильно подходят к расчету изменения температуры. А вот охарактеризовать химические свойства нафталина, даже написав его структурную формулу, смогли немногие. В итоге на общем фоне эта задача - чемпион. Средний балл 3,2, максимальный балл - 9,5, нет решения у 2 участников. Задача 10-4. 1. Реакция (CH3)3CH приводит к образованию монохлорзамещенных углеводородов. Из них 31% приходится на третичный атом углерода и 69% на первичный.
Отношение скоростей замещения у первичного и третичного атома углерода найдем из данных этой таблицы, оно равно 7,67:31 = 1:4
Отношение скоростей замещения у первичного и вторичного атома углерода найдем из второй таблицы, оно равно 4,67:12 = 1: 2,6. Поскольку в условии задачи сказано (и подтверждается процентными соотношениями), что скорости замещения атомов водорода при первичном, вторичном и третичном атоме углерода не зависят от длины и структуры углеродного скелета, эти данные можно объединить. Таким образом, относительная реакционноспособность перв : втор : трет = 1 : 2,6 : 4 2. При хлорировании 2,4-диметилпентана может образоваться три продукта: 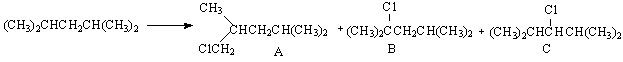
Сумма относительных количеств (25,2) отвечает всей смеси продуктов (100%). Исходя из этого рассчитывают процентное содержание каждого продукта (последняя колонка). (10 баллов) К такому анализу реакционной способности большинство участников оказалось не очень готовы. Средний балл 1,7, максимальный балл - 7,6, нет решения у 4 участников. Задача 10-5. 1. Вещество – металл калий и соответствующий химический элемент калий 2K + 2H2O = KOH + H2 2. Г.Дэви получил калий электролизом расплава гидроксида калия (гидроксид калия имеет более низкую температуру плавления по сравнению с солями). Катод: K+ + e = K Анод: 4OH- – 4e = O2 + 2H2O 4KOH = 4K + O2 + 2H2O 3. Чаще всего калий встречается в составе хлоридов сильвинита (Na,K)Cl, сильвина (KCl), карналлита (KCl*MgCl2*6H2O), силикатов (полевой шпат). Основные залежи его минералов в России находятся в Приуралье (Пермский край, г.Березники. «Древнее Пермское море охватывало весь Восток Европейской части России. Отдельные его заливы, языки на севере заходили под самый Архангельск, на юге длинные рукава протягивались к Донецкому Бассейну и к Харькову. Начиная с Соликамска вплоть до юго-восточной части Уральского хребта, тянутся отдельные линзы калиевых месторождений» А.Е.Ферсман. Занимательная геохимия. 1948 ). Цвет обычно белый. Красноватый оттенок придают следы железа, синий цвет обусловлен присутствием в минерале примесей радиоактивного 40К, после распада которого образуются пустоты, придающие минералу синий цвет. 4. Питательная ценность (q) калийных удобрений рассчитывается как отношение массы K2O к массе соответствующего калийного соединения, содержащего то же количество калия, что и в K2O. Расчет носит условный характер. Одному молю K2O соответствует по содержанию калия 2 моль KCl. Условное содержание K2O в чистом хлориде калия равно: q = M(K2O)/2M(KCl) = 94/(2*74,5) = 63,08% Это и есть максимальное значение, в техническом хлориде калия оно ниже. 5. 2K + 2NH3(газ) = 2KNH2 + H2; амид калия K + 6NH3ж = [K(NH3)6]; комплексное соединение, гексаамминкалий (10 баллов) Чего только не открывал сэр Дэви в работах участников: и натрий и кальций, и магний.. А ведь была явная подсказка - один из трех элементов плодородия: N-P-K. Никто не написал и последнее уравнение, хотя образование амидов отметитли почти все. Средний балл 1,8, максимальный балл - 6,3. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Можаев Г. М., старший преподаватель |